Navegação por assunto "proteins"
- Página inicial
- →
- Navegação por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação por assunto "proteins"
Itens para a visualização no momento 101-120 de 257
-
. A glycoprotein with anti-inflammatory properties secreted by an Aspergillus nidulans modified strain. Journal of Venomous Animals and Toxins Including Tropical Diseases, v. 13, n. 2, p. 527-543, 2007.
Palavras-Chave: glycoproteins; aspergillus; inflammation; proteins; purification; chromatography
. A glycoprotein with anti-inflammatory properties secreted by an Aspergillus nidulans modified strain. Journal of Venomous Animals and Toxins Including Tropical Diseases, v. 13, n. 2, p. 527-543, 2007. Disponível em: http://repositorio.ipen.br/handle/123456789/7791. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Hemo-compatible properties of polymeric derivative of paracetamol. Journal of Biomaterials Science, Polymer Edition, v. 7, n. 6, p. 523-530, 1995.
Palavras-Chave: copolymers; monomers; proteins; surface coating; graft polymers; thrombosis
. Hemo-compatible properties of polymeric derivative of paracetamol. Journal of Biomaterials Science, Polymer Edition, v. 7, n. 6, p. 523-530, 1995. Disponível em: http://repositorio.ipen.br/handle/123456789/6909. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High level SARS-CoV-2 nucleocapsid refolding using mild condition for inclusion bodies solubilization: application of high pressure at pH 9.0. PLoS One, v. 17, n. 2, p. 1-14, 2022. DOI: 10.1371/journal.pone.0262591 Abstract: SARS-CoV-2 Nucleocapsid (N) is the most abundant viral protein expressed in host samples and is an important antigen for diagnosis. N is a 45 kDa protein that does not present disulfide bonds. Intending to avoid non-specific binding of SARS-CoV-2 N to antibodies from patients who previously had different coronaviruses, a 35 kDa fragment of N was expressed without a conserved motif in E. coli as inclusion bodies (N122-419-IB). Culture media and IB washing conditions were chosen to obtain N122-419-IB with high yield (370 mg/L bacterial culture) and protein purity (90%). High pressure solubilizes protein aggregates by weakening hydrophobic and ionic interactions and alkaline pH promotes solubilization by electrostatic repulsion. The association of pH 9.0 and 2.4 kbar promoted efficient solubilization of N122-419-IB without loss of native-like tertiary structure that N presents in IB. N122-419 was refolded with a yield of 85% (326 mg/L culture) and 95% purity. The refolding process takes only 2 hours and the protein is ready for use after pH adjustment, avoiding the necessity of dialysis or purification. Antibody binding of COVID-19-positive patients sera to N122-419 was confirmed by Western blotting. ELISA using N122-419 is effective in distinguishing between sera presenting antibodies against SARS-CoV-2 from those who do not. To the best of our knowledge, the proposed condition for IB solubilization is one of the mildest described. It is possible that the refolding process can be extended to a wide range of proteins with high yields and purity, even those that are sensible to very alkaline pH.
Palavras-Chave: coronaviruses; proteins; antibodies; enzyme immunoassay; pressure range mega pa 10-100
. High level SARS-CoV-2 nucleocapsid refolding using mild condition for inclusion bodies solubilization: application of high pressure at pH 9.0. PLoS One, v. 17, n. 2, p. 1-14, 2022. DOI: 10.1371/journal.pone.0262591. Disponível em: http://repositorio.ipen.br/handle/123456789/33024. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015 Abstract: Prolactin is a pituitary hormone that is involved diverse physiological functions, such as lactation, reproduction, metabolism, osmoregulation, immunoregulation, and behavior. Its level of glycosylation is low in vivo, which favors its expression in bacterial systems. In the present work recombinant human prolactin (rec-hPRL) was expressed from the p1813-hPRL vector in Escherichia coli strain in inclusion bodies with 530.67 mg of rec-hPRL per liter of induced bacterial culture. The solubilization and renaturation of rec-hPRL followed by two methods described in the literature for this protein: one with detergent and basic pH, and other urea and dialyses was done by studying. The protocol with detergent/basic pH was not successful, whereas protocol with urea/dialyses was obtained pure protein and this was optimized. Rec-hPRL was obtained in a soluble, pure and active form, when the sample was 8-fold concentrated in the solubilization phase, allowing 33% recovery, 3-fold more that the original method. The pure protein was obtained with 38.37 i. u./mg activity, which is three times greater than that of the PRL standard from the WHO. In conclusion, this work obtained the highest production of rechPRL, and concentrating the sample eight times in the solubilization stage was decisive for obtaining a highly concentrated, active protein for future work.
Palavras-Chave: lth; hormones; biological effects; bacteria; proteins; in vitro; bioassay; statistical data; lactogens; pituitary hormones; biotechnology
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015. Disponível em: http://repositorio.ipen.br/handle/123456789/29259. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High-pressure refolding of aggregated fusion proteins: endostatin-proapoptotic peptides with enhanced antiangiogenic activity. In: CONFERENCE ON RECOMBINANT PROTEIN PRODUCTION, 5th, September 24-28, 2008, Alghero, Italy. Abstract... 2008. p. 141.
Palavras-Chave: proteins; collagen; gene recombination; endothelium; peptides; apoptosis; hydrostatics; pressure dependence
. High-pressure refolding of aggregated fusion proteins: endostatin-proapoptotic peptides with enhanced antiangiogenic activity. In: CONFERENCE ON RECOMBINANT PROTEIN PRODUCTION, 5th, September 24-28, 2008, Alghero, Italy. Abstract... 2008. p. 141. Disponível em: http://repositorio.ipen.br/handle/123456789/19615. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High-yield purification of biosynthetic human growth hormone secreted in Escherichia coli periplasmic space. Journal Chromatography, A, v. 852, n. 2, p. 441-450, 1999.
Palavras-Chave: sth; biosynthesis; escherichia coli; proteins; precipitation; chromatography
. High-yield purification of biosynthetic human growth hormone secreted in Escherichia coli periplasmic space. Journal Chromatography, A, v. 852, n. 2, p. 441-450, 1999. Disponível em: http://repositorio.ipen.br/handle/123456789/6289. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. HSP70 expression in Biomphalaria glabrata snails exposed to cadmium. Ecotoxicology and Environmental Safety, v. 140, p. 18-23, 2017. DOI: 10.1016/j.ecoenv.2017.02.026 Abstract: In this study, the effects of the heavy metal cadmium on the stress protein HSP70 are investigated in freshwater mollusks Biomphalaria glabrata. Adult snails were exposed for 96 h to CdCl2 at concentrations ranging from 0.09 to 0.7 mg L-1 (LC50/96 (h) = 0.34 (0.30-0.37). Time and concentration-dependent increases in the expression of HSP70 were observed at sub-lethal levels in the immunoblotting assay. Further, an increased survival to a lethal heat shock was observed in animals pre-exposed to a nonlethal concentration of cadmium, evidencing the induction of acquired tolerance. The present study demonstrated the inducibility of B. glabrata HSP70 by cadmium, a relevant environmental contaminant, at non-lethal levels, providing evidences that the assessment of HSP70 in B. glabrata can be regarded as a suitable biomarker for ecotoxicological studies.
Palavras-Chave: induction; proteins; biological markers; biological indicators; molluscs
. HSP70 expression in Biomphalaria glabrata snails exposed to cadmium. Ecotoxicology and Environmental Safety, v. 140, p. 18-23, 2017. DOI: 10.1016/j.ecoenv.2017.02.026. Disponível em: http://repositorio.ipen.br/handle/123456789/27841. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Human bone morphogenetic protein (hBMP)-2 characterization by physical chemical, immunological and biological assays. Journal of Biotechnology, v. 305, S, p. S10-S10, 2019. DOI: 10.1016/j.jbiotec.2019.05.050 Abstract: Commercial preparations of human-met-BMP-2 (GenScript) and of CHO-derived hBMP-2 (Infuse-Medtronic) provided a complete characterization of this protein, which belongs to the “transforming growth factors β” superfamily, via SDS-PAGE, Western blotting, reversed-phase HPLC, high-performance size-exclusion chromatography and MALDI-TOF-MS. E.coli-derived met-hBMP-2 has shown a large presence of dimer (MM= 26,054 Da), versus a theoretic value of 26,072 Da. More complex was the distribution of the CHO-derived product, whose exact MM has never been reported due to variable glycosylation: via MALDI-TOF-MS a dimer (28,732 Da) and a large amount of monomer (14,377 Da) were found. A novel method based on RP-HPLC was also validated for hBMP-2 qualitative and quantitative analysis directly in ongoing culture media. The classical “in vitro” bioassay, via alkaline phosphatase induction in murine myoblastic cells C2C12, confirmed that hBMP-2 bioactivity is mostly related to the dimer, being ∼6-fold higher for the CHO-derived glycosylated form. Considering that hBMP-2 is a highly effective osteoinductors, plays an important role during bone regeneration and repair, as well as during embryonic development, and presents an extremely high aggregate value, we believe that these data pave the way to the characterization of this important factor when obtained by DNA recombinant techniques in different host cells.
Palavras-Chave: proteins; skeleton; human populations; bone cells; cho cells; bioassay; escherichia coli; connective tissue cells
. Human bone morphogenetic protein (hBMP)-2 characterization by physical chemical, immunological and biological assays. Journal of Biotechnology, v. 305, p. S10-S10, 2019. S, DOI: 10.1016/j.jbiotec.2019.05.050. Disponível em: http://repositorio.ipen.br/handle/123456789/30934. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Human bone morphogenetic protein‑2 (hBMP‑2) characterization by physical–chemical, immunological and biological assays. AMB Express, v. 10, n. 1, p. 1-10, 2020. DOI: 10.1186/s13568-020-0964-5 Abstract: Commercially available preparations of methionyl-human BMP-2 and CHO-derived hBMP-2, which belongs to the transforming growth factor β (TGF-β) superfamily, were used for a complete characterization. This protein is an extremely efficient osteoinductor that plays an important role during bone regeneration and embryonic development. Characterization was carried out via SDS-PAGE and Western blotting, followed by reversed-phase HPLC, sizeexclusion HPLC and MALDI-TOF-MS. The classical in vitro bioassay, based on the induction of alkaline phosphatase activity in C2C12 cells, confirmed that hBMP-2 biological activity is mostly related to the dimeric form, being ~ 4-fold higher for the CHO-derived glycosylated form when compared with the E. coli counterpart. The E. coli-derived methBMP- 2 has shown, by MALDI-TOF-MS, a large presence of the bioactive dimer. A more complex molecular mass (MM) distribution was found for the CHO-derived product, whose exact MM has never been reported because of its variable glycosylation. A method based on RP-HPLC was set up, allowing a quantitative and qualitative hBMP-2 determination even directly on ongoing culture media. Considering that hBMP-2 is highly unstable, presenting moreover an extremely high aggregate value, we believe that these data pave the way to a necessary characterization of this important factor when synthesized by DNA recombinant techniques in different types of hosts.
Palavras-Chave: proteins; skeleton; human populations; bone cells; cho cells; bioassay; escherichia coli; connective tissue cells
. Human bone morphogenetic protein‑2 (hBMP‑2) characterization by physical–chemical, immunological and biological assays. AMB Express, v. 10, n. 1, p. 1-10, 2020. DOI: 10.1186/s13568-020-0964-5. Disponível em: http://repositorio.ipen.br/handle/123456789/31104. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Human growth hormone inclusion bodies present native‑like secondary and tertiary structures which can be preserved by mild solubilization for refolding. Microbial Cell Factories, v. 21, n. 1, p. 1-10, 2022. DOI: 10.1186/s12934-022-01887-1 Abstract: Background: Native-like secondary structures and biological activity have been described for proteins in inclusion bodies (IBs). Tertiary structure analysis, however, is hampered due to the necessity of mild solubilization conditions. Denaturing reagents used for IBs solubilization generally lead to the loss of these structures and to consequent reaggregation due to intermolecular interactions among exposed hydrophobic domains after removal of the solubilization reagent. The use of mild, non-denaturing solubilization processes that maintain existing structures could allow tertiary structure analysis and increase the efficiency of refolding. Results: In this study we use a variety of biophysical methods to analyze protein structure in human growth hormone IBs (hGH-IBs). hGH-IBs present native-like secondary and tertiary structures, as shown by far and near-UV CD analysis. hGH-IBs present similar λmax intrinsic Trp fluorescence to the native protein (334 nm), indicative of a native-like tertiary structure. Similar fluorescence behavior was also obtained for hGH solubilized from IBs and native hGH at pH 10.0 and 2.5 kbar and after decompression. hGH-IBs expressed in E. coli were extracted to high yield and purity (95%) and solubilized using non-denaturing conditions [2.4 kbar, 0.25 M arginine (pH 10), 10 mM DTT]. After decompression, the protein was incubated at pH 7.4 in the presence of the glutathione-oxidized glutathione (GSH-GSSG) pair which led to intramolecular disulfide bond formation and refolded hGH (81% yield). Conclusions: We have shown that hGH-IBs present native-like secondary and tertiary structures and that non-denaturing methods that aim to preserve them can lead to high yields of refolded protein. It is likely that the refolding process described can be extended to different proteins and may be particularly useful to reduce the pH required for alkaline solubilization.
Palavras-Chave: proteins; hormones; pressure dependence; ph value
. Human growth hormone inclusion bodies present native‑like secondary and tertiary structures which can be preserved by mild solubilization for refolding. Microbial Cell Factories, v. 21, n. 1, p. 1-10, 2022. DOI: 10.1186/s12934-022-01887-1. Disponível em: http://repositorio.ipen.br/handle/123456789/33450. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Hydrid protein endostatin-bax presents higher degree of apoptosis than endostatin after its internalization by endothelial cell line. (C-PAE). In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 34., 21-25 de maio, 2007, Salvador, BA. Resumo... 2007.
Palavras-Chave: proteins; hybridization; gene therapy; apoptosis; endothelium; mutagens
. Hydrid protein endostatin-bax presents higher degree of apoptosis than endostatin after its internalization by endothelial cell line. (C-PAE). In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 34., 21-25 de maio, 2007, Salvador, BA. Resumo... 2007. Disponível em: http://repositorio.ipen.br/handle/123456789/22817. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Identificação e quantificação de ácidos graxos em frutos amazônicos com potencial farmacológico via técnicas cromatográficas / Identification and techniques via chromatographic quantification of fatty acid in fruit with potential pharmacological amazon . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 77 p. Orientador: José Oscar Willian Vega Bustillos. DOI: 10.11606/D.85.2012.tde-16012013-145227 Abstract: A região amazônica apresenta grande quantidade de plantas perenes, com particular relevância para as espécies frutíferas. Os frutos amazônicos são conhecidos pelo seu grande potencial energético e são usados como fonte de alimento nas grandes regiões do país. Dentre esses frutos, destaca-se o açaí, fruto do açaizeiro (Euterpe oleracea Martius), a copaíba (Copaifera officinalis L.) e a castanha do Pará (Bertholletia excelsa). Esses frutos são importantes para o desenvolvimento agroindustrial da região amazônica. Os mesmos contêm na sua composição proteínas, fibras e ácidos graxos. Os frutos possuem ácidos graxos são usados na área farmacêutica, com finalidade clínica e dermatológica. O projeto tem como objetivo apresentar técnicas analíticas de caracterização e quantificação dos ácidos graxos presente na composição oleosa dos frutos e descrever a ação farmacológica. Esses ácidos são o oléico, linoleico e palmítico. As técnicas analíticas com características de quantificação deverão gerar informações confiáveis e interpretáveis sobre a amostra, sendo o critério de avaliação denominado validação. A validação foi estudada neste trabalho, visando ter confiabilidade e reprodutibilidade nos resultados. Os processos analíticos com características de identificação e quantificação aplicados nesse projeto são: a cromatografia a gás acoplada a espectrometria de massas (CG/MS), a espectrometria de massas Tanden (MS/MS) e cromatografia líquida de alta eficiência com detector ultra violeta (HPLC/UV). Os resultados demonstram que os três frutos amazônicos comtem ácidos oléico, linoleico e palmítico em proporções diferentes potencializando seu uso em aplicações farmacêuticas, específicamente em tratamentos dermatológicos.
Palavras-Chave: food processing; fruits; proteins; fibers; carboxylic acids; analytic functions; gas chromatography; mass spectroscopy; high-performance liquid chromatography; pharmacology; dermatitis; therapy
. Identificação e quantificação de ácidos graxos em frutos amazônicos com potencial farmacológico via técnicas cromatográficas. Orientador: José Oscar Willian Vega Bustillos. 2012. 77 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-16012013-145227. Disponível em: http://repositorio.ipen.br/handle/123456789/10149. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Identification of novel bradykinin-potentiating peptides (BPPs) in the venom gland of a rattlesnake allowed the evaluation of the structure-function relationship of BPPs. Biochemical Pharmacology, v. 74, p. 1350-1360, 2007.
Palavras-Chave: snakes; venoms; polypeptides; kinins; precursor; proteins; blood pressure; toxins
. Identification of novel bradykinin-potentiating peptides (BPPs) in the venom gland of a rattlesnake allowed the evaluation of the structure-function relationship of BPPs. Biochemical Pharmacology, v. 74, p. 1350-1360, 2007. Disponível em: http://repositorio.ipen.br/handle/123456789/7822. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Identification of the nuclear factor kappa-beta (NF-kB) in cortical of mice wistar using technovit 7200 VCR. Medicina Oral Patologia Oral y Cirugia Bucal, v. 16, n. 1, p. e124-e131, 2011.
Palavras-Chave: immunity; histological techniques; chemistry; bone cells; femur; calcium; rats; proteins
. Identification of the nuclear factor kappa-beta (NF-kB) in cortical of mice wistar using technovit 7200 VCR. Medicina Oral Patologia Oral y Cirugia Bucal, v. 16, n. 1, p. e124-e131, 2011. Disponível em: http://repositorio.ipen.br/handle/123456789/8183. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Immune response against irradiated with sup(60)Co gamma-rays. Journal of Radioanalytical and Nuclear Chemistry, v. 269, n. 3, p. 565-569, 2006.
Palavras-Chave: antigens; cobalt 60; gamma radiation; immune reactions; irradiation; proteins; toxic materials
. Immune response against irradiated with sup(60)Co gamma-rays. Journal of Radioanalytical and Nuclear Chemistry, v. 269, n. 3, p. 565-569, 2006. Disponível em: http://repositorio.ipen.br/handle/123456789/7713. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Immunogenic properties of the M. leprae recombinant 18-kDa antigen purified from Saccharomyces-cerevisiae; enhancement of delayed-type hypersensitivity after gamma-irradiation. International Journal of Leprosy and Other Mycobacterial Diseases, v. 63, n. 3, p. 381-390, 1995.
Palavras-Chave: biological materials; proteins; irradiation; gamma radiation; antigens; immunity; leprosy; skin diseases; mycobacterium; monoclonal antibodies; chromatography
. Immunogenic properties of the M. leprae recombinant 18-kDa antigen purified from Saccharomyces-cerevisiae; enhancement of delayed-type hypersensitivity after gamma-irradiation. International Journal of Leprosy and Other Mycobacterial Diseases, v. 63, n. 3, p. 381-390, 1995. Disponível em: http://repositorio.ipen.br/handle/123456789/7955. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Immunoradiometric assay (IRMA) for the detection of E.coli proteins in recombinant human growth hormone prepared at IPEN-CNEN/SP. In: 21a. REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, May 16-19, 1992, Caxambu, MG. Abstract... 1992. p. 360.
Palavras-Chave: radioimmunoassay; proteins; sth
. Immunoradiometric assay (IRMA) for the detection of E.coli proteins in recombinant human growth hormone prepared at IPEN-CNEN/SP. In: 21a. REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, May 16-19, 1992, Caxambu, MG. Abstract... 1992. p. 360. Disponível em: http://repositorio.ipen.br/handle/123456789/21331. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Implications on the Pb bioaccumulation and metallothionein levels due to dietary and waterborne exposures: the Callinectes danae case. Ecotoxicology and Environmental Safety, v. 162, p. 415-422, 2018. DOI: 10.1016/j.ecoenv.2018.07.014 Observação: Corrigendum anexado. Ecotoxicology and Environmental Safety, v. 165, p. 675–676. DOI: 10.1016/j.ecoenv.2018.08.085 Abstract: This study aimed to assess the bioaccumulation of Pb and induction of metallothionein-like proteins (MT) in Callinectes danae through single and combined dietary and waterborne exposures. Male C. danae individuals were collected in the south area of the Cananéia-Iguape-Peruíbe Protected Area (APA-CIP), in São Paulo State, Brazil. After an acclimatization period, exposure assays were performed during 7 and 14 days, at two Pb concentrations (0.5 e 2.0 µg/g) in 4 treatments: 1) control; 2) contaminated water only; 3) contaminated food only; 4) contaminated water and food. The results indicate that C. danae is highly tolerant to Pb exposure at the evaluated concentrations. In gills, Pb bioaccumulation is more dependent of water efflux and time of exposure (higher Pb values). However, pathways act simultaneously in the induction of MT expression in this tissue. The decreases in Pb accumulation in the combined treatments and MT increases after 14 days in gills suggests that these proteins play a detoxification function in the presence of Pb. In hepatopancreas, depending on the predominance of a certain pathway or combined pathways, accumulation occured at different times. For muscle tissue, bioaccumulation was observed due to contaminated water exposure, but not dietary exposure, probably because Pb concentrations were low.
Palavras-Chave: biological accumulation; lead; metals; biological markers; crabs; crustaceans; proteins; metallothionein; ecological concentration; seawater; food
. Implications on the Pb bioaccumulation and metallothionein levels due to dietary and waterborne exposures: the Callinectes danae case. Ecotoxicology and Environmental Safety, v. 162, p. 415-422, 2018. DOI: 10.1016/j.ecoenv.2018.07.014. Disponível em: http://repositorio.ipen.br/handle/123456789/29276. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Indirect labeling of proteins with radioiodine. In: CONGRESSO GERAL DE ENERGIA NUCLEAR, 8.; ENCONTRO NACIONAL DE APLICACOES NUCLEARES, 5., 5-20 out, 2000, Rio de Janeiro, RJ. Anais... Rio de Janeiro: ABEN, 2000, 2000.
Palavras-Chave: proteins; labelling; iodination; chemical preparation; brominated aromatic hydrocarbons; iodine 131; biological localization; immunoglobulins
. Indirect labeling of proteins with radioiodine. In: CONGRESSO GERAL DE ENERGIA NUCLEAR, 8.; ENCONTRO NACIONAL DE APLICACOES NUCLEARES, 5., 5-20 out, 2000, Rio de Janeiro, RJ. Anais... Rio de Janeiro: ABEN, 2000, 2000. Disponível em: http://repositorio.ipen.br/handle/123456789/13342. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Influence of activation temperature on the degradation of recombinant proteins in E.coli. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 37., 17-20 de maio, 2008, Aguas de Lindoia, SP. Resumo... 2008.
Palavras-Chave: sth; proteins; recombinant dna; escherichia coli
. Influence of activation temperature on the degradation of recombinant proteins in E.coli. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 37., 17-20 de maio, 2008, Aguas de Lindoia, SP. Resumo... 2008. Disponível em: http://repositorio.ipen.br/handle/123456789/22373. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 101-120 de 257
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

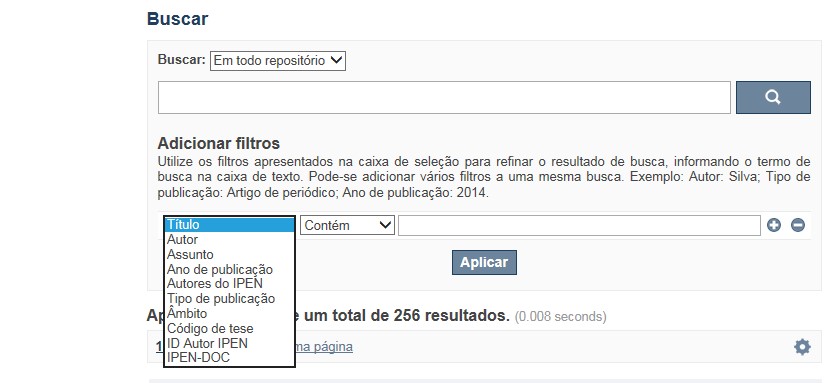
A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
