Navegação por assunto "pituitary gland"
- Página inicial
- →
- Navegação por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação por assunto "pituitary gland"
Itens para a visualização no momento 1-20 de 26
-
. Analysis and characterization of different preparations of recombinant human follicie stimulating hormone (hFSH) and of subunits. In: RECOMBINANT PROTEIN PRODUCTION MEETING, 4th, Sept. 21-23, 2006, Barcelona, Spain. Abstract... 2006.
Palavras-Chave: fsh; pituitary gland; urinary tract; cho cells; high-performance liquid chromatography
. Analysis and characterization of different preparations of recombinant human follicie stimulating hormone (hFSH) and of subunits. In: RECOMBINANT PROTEIN PRODUCTION MEETING, 4th, Sept. 21-23, 2006, Barcelona, Spain. Abstract... 2006. Disponível em: http://repositorio.ipen.br/handle/123456789/19950. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Application of a human thyrotropin purified from hypophyses at IPEN-CNEN/SP in the preparation of the radioimmunoassay tracer:/sup (125)I/h TSH. In: 6th JAPAN-BRAZIL SYMPOSIUM ON SCIENCE AND TECHNOLOGY, Aug. 10-13, 1988, Sao Paulo, SP. 1988.
Palavras-Chave: tsh; pituitary gland; labelling; radioimmunoassay
. Application of a human thyrotropin purified from hypophyses at IPEN-CNEN/SP in the preparation of the radioimmunoassay tracer:/sup (125)I/h TSH. In: 6th JAPAN-BRAZIL SYMPOSIUM ON SCIENCE AND TECHNOLOGY, Aug. 10-13, 1988, Sao Paulo, SP. 1988. Disponível em: http://repositorio.ipen.br/handle/123456789/12997. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Avaliacao da responsabilidade da hipofise ao hormonio hipotalamico (THR) em ratos, no periodo das 8:00 as 12:00 horas. 1977. 7 p.
Palavras-Chave: iodine 125; pituitary gland; tracer techniques; trh
. Avaliacao da responsabilidade da hipofise ao hormonio hipotalamico (THR) em ratos, no periodo das 8:00 as 12:00 horas. 1977. 7 p. (.IEA-PUB-486 ). Disponível em: http://repositorio.ipen.br/handle/123456789/24871. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Caracterizacao da ligacao do hormonio do crescimento humano a membrana microssomal de figado de mulher gravida. 1990. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 67 p. Orientador: Wilian Nicolau.
Palavras-Chave: sth; women; liver; pregnancy; membranes; radioimmunoassay; blood serum; peptides; pituitary gland; ligands; receptors
. Caracterizacao da ligacao do hormonio do crescimento humano a membrana microssomal de figado de mulher gravida. Orientador: Wilian Nicolau. 1990. 67 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10240. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Charge isomer distribution of different pituitary and recombinant human thyrotropin (hTSH) preparations. In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 39., 18-21 de maio, 2010, Foz do Iguacu, PR. Resumos... 2010. p. 68.
Palavras-Chave: tsh; carbohydrates; glycoproteins; pituitary gland; recombinant dna; structural chemical analysis; high-performance liquid chromatography
. Charge isomer distribution of different pituitary and recombinant human thyrotropin (hTSH) preparations. In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 39., 18-21 de maio, 2010, Foz do Iguacu, PR. Resumos... 2010. p. 68. Disponível em: http://repositorio.ipen.br/handle/123456789/21257. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Contribuição ao conhecimento das alterações do eixo hipotálamo-hipófise-tireóideo na hipoproteinemia experimental em ratos wistar albinos (Rattus Norvegicus Albinus). 1977. Tese (Doutoramento) - Instituto de Biociencias, Universidade de Sao Paulo - IB/USP, Sao Paulo. 108 p. Orientador: Ary dos Santos do Amaral.
Palavras-Chave: hypothalamus; nutritional deficiency; pituitary gland; proteins; rats; thyroid; tsh
. Contribuição ao conhecimento das alterações do eixo hipotálamo-hipófise-tireóideo na hipoproteinemia experimental em ratos wistar albinos (Rattus Norvegicus Albinus). Orientador: Ary dos Santos do Amaral. 1977. 108 f. Tese (Doutoramento) - Instituto de Biociencias, Universidade de Sao Paulo - IB/USP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/11309. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Correção fenotípica do nanismo avaliada por diferentes parâmetros de crescimento após administração de DNA plasmidial em modelo animal de deficiência isolada do hormônio do crescimento / Phenotypic correction of dwarfism mediated by different growth parameters after plasmid DNA administration in an animal model of isolated growth hormone deficiency . 2016. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 97 p. Orientador: Cibele Nunes Peroni. DOI: 10.11606/T.85.2016.tde-07032016-091035 Abstract: A deficiência de hormônio de crescimento (DGH) é a deficiência mais comum entre os hormônios pituitários. A terapia utilizada atualmente consiste de injeções diárias de hormônio de crescimento humano recombinante (r-hGH), entretanto esta terapia apresenta alguns inconvenientes, como a necessidade de frequentes injeções de r-hGH durante um longo período de vida, dependendo da severidade da deficiência, e o alto custo do hormônio, em razão dos dispendiosos processos de purificação. Uma alternativa ao tratamento padrão seria aquele no qual fossem evitados estes tipos de inconvenientes e o processo de liberação da proteína fosse sustentável, por um longo período e promovesse níveis normais e sustentáveis do fator de crescimento semelhante à insulina I (IGF-I), o principal mediador dos efeitos do GH. Uma alternativa é a terapia gênica in vivo, baseada na administração de DNA plasmidial em diversos órgãos/tecidos, seguida de eletroporação. É considerada uma metodologia bastante promissora e que tem sido alvo de vários estudos para diversos tipos de deficiências sistêmicas. Neste trabalho foram realizadas diversas administrações de um plasmídeo contendo o gene do hormônio de crescimento humano, nos músculos quadríceps exposto ou tibial anterior sem exposição, seguidas de eletroporação, em camundongos anões e imunodeficientes (lit/scid) com 40-80 dias de idade, na tentativa de obter uma correção fenotípica do nanismo, mediante a avaliação de parâmetros de crescimento. A administração deste plasmídeo no músculo tibial anterior, em camundongos com a idade inicial de 40 dias, foi capaz de proporcionar uma normalização dos níveis de mIGF-I, quando comparados aos dos camundongos não-deficientes de GH. Além disso, foram obtidos valores de catch-up dos parâmetros de crescimento longitudinal de 36-77%. Visando uma maior eficiência na expressão de GH, foram construídos plasmídeos parentais, e a partir destes, foram produzidos minicírculos de DNA com os promotores do CMV e Ubiquitina C e com os cDNAs de hGH e mGH. Estes minicírculos de DNA foram transfectados em células HEK 293 e foram até 2 vezes mais eficientes em relação aos plasmídeos convencionais com o promotor do CMV. Estes dados são bastantes promissores e abrem caminho para ensaios mais eficientes, utilizando este tipo de protocolo de terapia gênica para a DGH, visando uma normalização de todos os parâmetros de crescimento.
Palavras-Chave: biotechnology; biological regeneration; genetics; biological repair; dna repair; plasmids; hormones; endocrine glands; pituitary gland; animal growth; diseases; immunotherapy; electric fields; transformers; animal cells; cell cultures; permeability; cell membranes; cell constituents
. Correção fenotípica do nanismo avaliada por diferentes parâmetros de crescimento após administração de DNA plasmidial em modelo animal de deficiência isolada do hormônio do crescimento. Orientador: Cibele Nunes Peroni. 2016. 97 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2016.tde-07032016-091035. Disponível em: http://repositorio.ipen.br/handle/123456789/26374. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Efficient isolation of the subunits of recombinant and pituitary glycoprotein. Journal of Chromatography, A, v. 1216, n. 9, p. 1431-1438, 2009.
Palavras-Chave: fsh; luteinizing hormone; tsh; pituitary gland; pituitary hormones; recombinant dna; high-performance liquid chromatography
. Efficient isolation of the subunits of recombinant and pituitary glycoprotein. Journal of Chromatography, A, v. 1216, n. 9, p. 1431-1438, 2009. Disponível em: http://repositorio.ipen.br/handle/123456789/7987. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Eixo hipotalano-hipofise-adrenal em individuos normais antes e apos suspencao do tratamento com glicocorticoide sintetico. Arquivos Brasileiros de Endocrinologia e Metabologia, v. 30, n. 1, p. 1-6, 1986.
Palavras-Chave: adrenal glands; daily variations; glucocorticoids; hypothalamus; insulin; patients; pituitary gland
. Eixo hipotalano-hipofise-adrenal em individuos normais antes e apos suspencao do tratamento com glicocorticoide sintetico. Arquivos Brasileiros de Endocrinologia e Metabologia, v. 30, n. 1, p. 1-6, 1986. Disponível em: http://repositorio.ipen.br/handle/123456789/6879. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Expressão de tireotrofina humana em células de embrião de rim humano (HEK293) / Human tryrotropin expression in human embrionic kidney cells (HEK293) . 2016. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 64 p. Orientador: Maria Teresa de Carvalho Pinto Ribela. DOI: 10.11606/D.85.2016.tde-05122016-160030 Abstract: Neste trabalho foi transfectada uma linhagem de células embrionárias de rim humano (HEK293) com os genes das subunidades α e β da tireotrofina humana (hTSH), hormônio glicoproteico secretado pela hipófise. Após 5 dias de cultivo obteve-se uma concentração de hTSH no meio condicionado de 0,95μg/mL. O material foi concentrado e purificado utilizando uma estratégia envolvendo duas etapas, uma cromatografia de troca catiônica e uma cromatografia líquida de alta eficiência (HPLC) de fase reversa, que permitiu uma recuperação de 55% e uma pureza >90%. O produto purificado (hTSH-HEK) foi analisado e comparado a uma preparação comercial obtida em células CHO (hTSH-CHO) e a uma preparação hipofisária (hTSH-Pit). A identidade e a pureza do hTSH-HEK foram avaliadas por métodos físicoquímicos e imunológico (espectrometria de massa MALDI-TOF, HPLC de exclusão molecular e de fase reversa, SDS-PAGE e ensaio imunoradiométrico). A porção glicídica do hTSH-HEK foi avaliada pela análise do perfil dos N-glicanos e o comportamento biológico deste hormônio foi avaliado por bioensaio in vivo e estudo farmacocinético. As 3 preparações apresentaram pureza equivalente (97%) e a massa molecular relativa do hTSH-HEK foi 2,1% menor do que a do hTSH-CHO e 2,7% maior do que a do hTSH-Pit. A maior hidrofobicidade relativa, avaliada por RP-HPLC, foi a do hTSH-HEK. Os N-glicanos identificados no hTSH-HEK foram do tipo complexo, apresentando predominantemente estruturas tri-antenárias, enquanto no hTSH-CHO e no hTSH-Pit as estruturas bi-antenárias foram predominantes. Foram detectadas diferenças significativas relacionadas à composição dos carboidratos para estas preparações, um teor muito menor de ácido siálico e muito maior de fucose foram observados no hTSHHEK. Foi confirmada a atividade biológica das 3 preparações, sendo a bioatividade do hTSHHEK 39% e 16% inferior à do hTSH-CHO e hTSH-Pit, respectivamente. A meia-vida circulatória do hTSH-HEK foi menor (1,5 X) que a do hTSH-CHO e a do hTSH-Pit (1,2 X). De acordo com esses resultados o hTSH-HEK pode ser considerado uma alternativa viável para aplicações clínicas especialmente por sua origem humana e composição de carboidratos.
Palavras-Chave: animal cells; kidneys; embryonic cells; animal tissues; tissue cultures; recombinant dna; trh; thyroid; liberins; peptide hormones; protein engineering; glycoproteins; pituitary gland; carbohydrates; bioassay; labelled compounds; cations; chromatography; high-performance liquid chromatography; gamma spectrometers; beta spectrometers; spectrometers; pulse analyzers; nuclear engineering
. Expressão de tireotrofina humana em células de embrião de rim humano (HEK293). Orientador: Maria Teresa de Carvalho Pinto Ribela. 2016. 64 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2016.tde-05122016-160030. Disponível em: http://repositorio.ipen.br/handle/123456789/26947. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Expressão e caracterização do hormônio folículo estimulante (FSH) de pirarucu (Arapaima gigas) / Expression and characterization of follicle stimulating hormone (FSH) of pirarucu (Arapaima gigas) . 2019. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 57 p. Orientador: Cibele Nunes Peroni. DOI: 10.11606/T.85.2019.tde-18092019-085010 Abstract: O Arapaima gigas, conhecido popularmente no Brasil como pirarucu, pertence ao grupo mais primitivo dos teleósteos, sendo um dos maiores peixes de água doce da América do Sul. Desde os anos 40 informações divergentes têm sido dadas em relação ao seu tamanho e peso máximo, porém todas concordam com o fato de que se trata de uma espécie de grande porte, com exemplares pesando de 125 a 200 quilos e um comprimento de 2 a 3 metros. Sua carne é desprovida de espinhas e apresenta baixo teor de gordura. Os níveis de rendimento da carcaça são elevados e o crescimento juvenil da espécie é consideravelmente rápido. Por isso, o pirarucu, apresenta um atraente valor de mercado e grande importância para o comércio de pescado amazônico. A pesca predatória tem reduzido significativamente a população dessa espécie nas regiões amazônicas ao longo dos anos. Sendo assim, desde os anos 2000, o pirarucu foi incluído na lista de animais sobre explorados ou em perigo de extinção do IBAMA. A ausência de um empreendimento de aquicultura capaz de produzir o pirarucu a preços competitivos, de forma previsível e em larga escala deve-se principalmente ao fato de que essa espécie, de um modo geral, apresenta dificuldades no processo reprodutivo em cativeiro, apresentando uma ovulação, espermiação e/ou maturação final gonadal insatisfatória. O hormônio folículo estimulante (FSH) é um hormônio gonadotrófico que exerce um papel importante na maturação folicular inicial das gônodas. Assim como os mamíferos, os peixes também apresentam hormônios gonadotróficos (GTHs) heterodiméricos, onde a subunidade α é comum entre os hormônios pertencentes a essa família e a subunidade β determina a atividade hormonal específica. As subunidades α e β do hormônio folículo estimulante de Arapaima gigas (ag-FSH) foram previamente isoladas pelo nosso grupo de pesquisa ao longo dos anos e possibilitaram um estudo de modelagem tridimensional baseada nas sequências de aminoácidos obtidas. Paralelamente, foi realizada a expressão do ag-FSH recombinante com níveis de rendimento satisfatórios (28 mg/L) através da expressão em células de embrião de rim humano (HEK 293), purificando-o e caracterizando-o a partir de técnicas cromatográficas padronizadas pelo nosso grupo de pesquisa.
Palavras-Chave: fishes; fsh; gonadotropins; glycoproteins; polypeptides; hormones; pituitary gland; dna sequencers; dna repair; thermal utilization; high-performance liquid chromatography; computerized simulation
. Expressão e caracterização do hormônio folículo estimulante (FSH) de pirarucu (Arapaima gigas). Orientador: Cibele Nunes Peroni. 2019. 57 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2019.tde-18092019-085010. Disponível em: http://repositorio.ipen.br/handle/123456789/30182. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Expression of glycosylated human prolactin in HEK293 cells and related N‑glycan composition analysis. AMB Express, v. 9, n. 1, p. 1-11, 2019. DOI: 10.1186/s13568-019-0856-8 Abstract: Prolactin (PRL) is a hormone produced by the pituitary gland with innumerable functions, such as lactation, reproduction, osmotic and immune regulation. The present work describes the synthesis of hPRL in human embryonic kidney (HEK293) cells, transiently transfected with the pcDNA-3.4-TOPO® vector carrying the hPRL cDNA. A concentration of ~ 20 mg/L, including glycosylated (G-hPRL) and non-glycosylated (NG-hPRL) human prolactin, was obtained, with ~ 19% of G-hPRL, which is higher than that observed in CHO-derived hPRL (~ 10%) and falling within the wide range of 5–30% reported for pituitary-derived hPRL. N-Glycoprofiling analysis of G-hPRL provided: (i) identification of each N-glycan structure and relative intensity; (ii) average N-glycan mass; (iii) molecular mass of the whole glycoprotein and relative carbohydrate mass fraction; (iv) mass fraction of each monosaccharide. The data obtained were compared to pituitary- and CHO-derived G-hPRL. The whole MM of HEK-derived G-hPRL, determined via MALDI–TOF-MS, was 25,123 Da, which is 0.88% higher than pit- and 0.61% higher than CHO-derived G-hPRL. The main difference with the latter was due to sialylation, which was ~ sevenfold lower, but slightly higher than that observed in native G-hPRL. The “in vitro” bioactivity of HEK-G-hPRL was ~ fourfold lower than that of native G-hPRL, with which it had in common also the number of N-glycan structures.
Palavras-Chave: hormones; pituitary gland; lth; kidneys; animal cells; mass spectroscopy; glycoproteins; bioassay
. Expression of glycosylated human prolactin in HEK293 cells and related N‑glycan composition analysis. AMB Express, v. 9, n. 1, p. 1-11, 2019. DOI: 10.1186/s13568-019-0856-8. Disponível em: http://repositorio.ipen.br/handle/123456789/30430. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Fracionamento de extrato hipofisario humano, em sephadex G100, para separacao do hormonio de crescimento. 1970. Dissertacao (Mestrado) - Faculdade de Medicina, Universidade de Sao Paulo - FM/USP, Sao Paulo. 39 p. Orientador: Licio Marques de Assis.
Palavras-Chave: chromatography; glands; pituitary gland; hormones
. Fracionamento de extrato hipofisario humano, em sephadex G100, para separacao do hormonio de crescimento. Orientador: Licio Marques de Assis. 1970. 39 f. Dissertacao (Mestrado) - Faculdade de Medicina, Universidade de Sao Paulo - FM/USP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/9094. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Glicoprotein alpha characterization of the Amazonia fis (Arapaima gigas). In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 40., 19-22 de maio, 2012, Foz do Iguacu, PR. Resumos... 2012.
Palavras-Chave: amazon river; fishes; glycoproteins; pituitary gland
. Glicoprotein alpha characterization of the Amazonia fis (Arapaima gigas). In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 40., 19-22 de maio, 2012, Foz do Iguacu, PR. Resumos... 2012. Disponível em: http://repositorio.ipen.br/handle/123456789/20144. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Glucocorticoids (GCs) glucose metabolism and HPA axis. In: 1st INTERNATIONAL COLLOQUIUM ON GLUCOCORTICOID EFFECTS, Sept. 22-24, 1982, Siena, Italy. Abstract... 1982.
Palavras-Chave: acth; adrenal glands; glucocorticoids; glucose; hydrocortisone; hypothalamus; insulin; pituitary gland
. Glucocorticoids (GCs) glucose metabolism and HPA axis. In: 1st INTERNATIONAL COLLOQUIUM ON GLUCOCORTICOID EFFECTS, Sept. 22-24, 1982, Siena, Italy. Abstract... 1982. Disponível em: http://repositorio.ipen.br/handle/123456789/20679. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Glucocorticoids glucose metabolism and hypothalamic-pituitary-adrenal axis. Advances in Experimental Medicine and Biology, v. 171, p. 25-44, 1984.
Palavras-Chave: glucocorticoids; glucose; metabolism; tolerance; insulin; pituitary gland; adrenal glands
. Glucocorticoids glucose metabolism and hypothalamic-pituitary-adrenal axis. Advances in Experimental Medicine and Biology, v. 171, p. 25-44, 1984. Disponível em: http://repositorio.ipen.br/handle/123456789/7797. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Lactate activates the somatotropic axis in rats. Growth hormone and IGF Research, v. 24, n. 1, p. 268-270, 2014.
Palavras-Chave: sth; insulin; messenger-rna; exercise; liver; pituitary gland
. Lactate activates the somatotropic axis in rats. Growth hormone and IGF Research, v. 24, n. 1, p. 268-270, 2014. Disponível em: http://repositorio.ipen.br/handle/123456789/23678. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Molecular cloning and characterization of pirarucu (Arapaima gigas) follicle-stimulating hormone and luteinizing hormone β-subunit cDNAs. Plos One, v. 12, n. 8, p. 1-22, 2017. DOI: 10.1371/journal.pone.0183545 Abstract: The common gonadotrophic hormone α-subunit (GTHα) has been previously isolated by our research group from A. gigas pituitaries; in the present work the cDNA sequences encoding FSHβ and LHβ subunits have also been isolated from the same species of fish. The FSH β-subunit consists of 126 amino acids with a putative 18 amino acid signal peptide and a 108 amino acid mature peptide, while the LH β-subunit consists of 141 amino acids with a putative 24 amino acid amino acid signal peptide and a 117 amino acid mature peptide. The highest identity, based on the amino acid sequences, was found with the order of Anguilliformes (61%) for FSHβ and of Cypriniformes (76%) for LHβ, followed by Siluriformes, 53% for FSHβ and 75% for LHβ. Interestingly, the identity with the corresponding human amino acid sequences was still remarkable: 45.1% for FSHβ and 51.4% for LHβ. Three dimensional models of ag-FSH and ag-LH, generated by using the crystal structures of h-FSH and h-LH as the respective templates and carried out via comparative modeling and molecular dynamics simulations, suggested the presence of the so-called ªseat-beltº, favored by a disulfide bond formed between the 3rd and 12th cysteine in both β-subunits. The sequences found will be used for the biotechnological synthesis of A. gigas gonadotrophic hormones (ag-FSH and ag-LH). In a first approach, to ascertain that the cloned transcripts allow the expression of the heterodimeric hormones, ag-FSH has been synthesized in human embryonic kidney 293 (HEK293) cells, preliminarily purified and characterized.
Palavras-Chave: hormones; pituitary gland; pituitary hormones; gonadotropins; fishes; luteinizing hormone; dna-cloning; molecular models
. Molecular cloning and characterization of pirarucu (Arapaima gigas) follicle-stimulating hormone and luteinizing hormone β-subunit cDNAs. Plos One, v. 12, n. 8, p. 1-22, 2017. DOI: 10.1371/journal.pone.0183545. Disponível em: http://repositorio.ipen.br/handle/123456789/28167. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Otimizacao da extracao de hormonio de crescimento humano a partir de hipofises congeladas. Ciência Cultura, v. 39, n. 2, p. 207-210, 1987.
Palavras-Chave: pituitary gland; electrophoresis; chromatography; radioimmunoassay
. Otimizacao da extracao de hormonio de crescimento humano a partir de hipofises congeladas. Ciência Cultura, v. 39, n. 2, p. 207-210, 1987. Disponível em: http://repositorio.ipen.br/handle/123456789/6658. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Physico-chemical characterization of alpha and beta subunit of recombinant human glycoprotein hormones: hTSH and hLH. In: ANNUAL MEETING OF THE BRAZILIAN SOCIETY FOR BIOCHEMISTRY AND MOLECULAR BIOLOGY, 36th, May 21-25, 2007, Salvador, BA. Abstracts... 2007.
Palavras-Chave: pituitary hormones; pituitary gland; cho cells; high-performance liquid chromatography; glycoproteins; mass spectroscopy; fsh; tsh
. Physico-chemical characterization of alpha and beta subunit of recombinant human glycoprotein hormones: hTSH and hLH. In: ANNUAL MEETING OF THE BRAZILIAN SOCIETY FOR BIOCHEMISTRY AND MOLECULAR BIOLOGY, 36th, May 21-25, 2007, Salvador, BA. Abstracts... 2007. Disponível em: http://repositorio.ipen.br/handle/123456789/20088. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-20 de 26
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

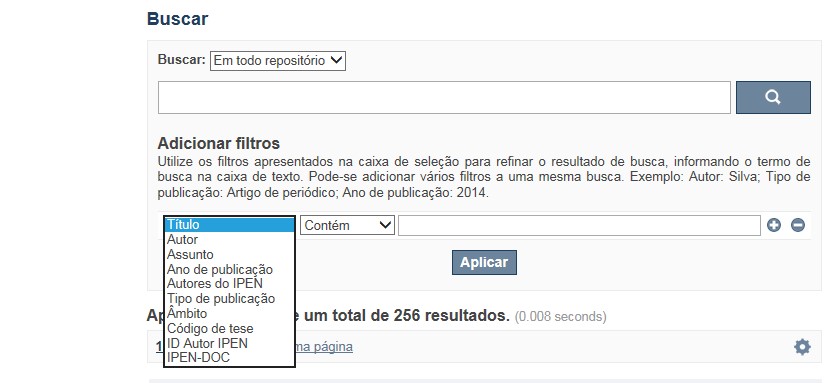
A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
