Navegação por assunto "pituitary hormones"
- Página inicial
- →
- Navegação por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação por assunto "pituitary hormones"
Itens para a visualização no momento 1-20 de 38
-
. Altos niveis de expressao de tireotrofina humana em celulas de ovario de hamster chines mediante a utilizacao de vetores dicistronicos. 1999. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 86 p. Orientador: Paolo Bartolini.
Palavras-Chave: tsh; cho cells; recombinant dna; clone cells; ovaries; gene amplification; cell cultures; bioreactors; radioimmunoassay; hormones; pituitary hormones
. Altos niveis de expressao de tireotrofina humana em celulas de ovario de hamster chines mediante a utilizacao de vetores dicistronicos. Orientador: Paolo Bartolini. 1999. 86 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10758. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Amplification of hTSH alfa and beta subunit genes by PCR, using pituitary cDNA for recombinant hTSH preparation. In: 22o. CONGRESSO BRASILEIRO DE ENDOCRINOLOGIA E METABOLOGIA, 17-21 de novembro, 1996, Salvador, BA. Abstract... 1996. p. 274.
Palavras-Chave: polymerase chain reaction; dna; tsh; recombinant dna; pituitary hormones
. Amplification of hTSH alfa and beta subunit genes by PCR, using pituitary cDNA for recombinant hTSH preparation. In: 22o. CONGRESSO BRASILEIRO DE ENDOCRINOLOGIA E METABOLOGIA, 17-21 de novembro, 1996, Salvador, BA. Abstract... 1996. p. 274. Disponível em: http://repositorio.ipen.br/handle/123456789/22507. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Baculovirus system as an alternative to express human pituitary hormones. In: 22rd REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, May 14-17, 1994, Caxambu, MG. Abstract... 1994. p. 75. Observação: arquivo não disponível no Repositório
Palavras-Chave: pituitary hormones; peptide hormones; lth; fsh; glycoproteins; dna
. Baculovirus system as an alternative to express human pituitary hormones. In: 22rd REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, May 14-17, 1994, Caxambu, MG. Abstract... 1994. p. 75. Disponível em: http://repositorio.ipen.br/handle/123456789/21954. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Bioquímica estrutural da tireotrofina de Arapaima gigas e sua expressão em células de mamífero / Structural biochemistry of Arapaima gigas thyrotropin and its expression in mammalian cells . 2022. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 133 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2022.tde-08112022-105344 Abstract: Introdução: O Pirarucu (Arapaima gigas) é uma espécie de peixe nativa da bacia amazônica que pode alcançar até 200 kg e dois metros de comprimento. Alvo de pesca predatória e modificações ambientais, especialmente político-econômicas, já se nota um relativo declínio da população local e, segundo órgãos fiscalizadores, a espécie está em possível risco de extinção. Há ainda uma dificuldade no manejo em cativeiro, visto sua gama de necessidades nutricionais e comportamentos que ainda são investigados. A tireotrofina (TSH) atua no controle da reprodução em diferentes espécies de peixes. E do ponto de vista ecológico tem sua expressão modificada quando em contato com substâncias poluentes, como metais pesados e agrotóxicos. O TSH é uma glicoproteína de peso molecular variando de 24-28 kDa formada pela ligação não-covalente de duas subunidades alfa e beta, sendo a alfa comum para outros hormônios glicoproteicos, como o FSH, LH e CG. Sua função é bem estabelecida, participando diretamente na síntese dos hormônios tireoidianos (HTs) que atuam no desenvolvimento embrionário, modulação da atividade cerebral, gonadal, hepática, entre outros. Objetivos: Obter a subunidade beta do TSH de Arapaima gigas, caracterizar sua estrutura in silico e expressar em células de mamífero. Metodologia: Foram utilizadas metodologias de identificação genômica da subunidade beta in silico e construção da estrutura do heterodímero com técnicas de inteligência artificial. Aplicou-se duas ferramentas de predição: gênica (Gnomon) e estrutural (Alphafold), como também se realizou in silico estudos sobre distância evolutiva, dinâmica molecular e propriedades físico-químicas. As informações recuperadas das predições foram em parte confirmadas com PCR de hipófises retiradas de Pirarucus e a expressão de agTSH em células de mamífero HEK293F. Resultados: A similaridade da cadeia beta variou de 40,10-81,60% entre 39 espécies alinhadas com a sequência obtida. São 146 aminoácidos com 12 cisteínas (que formam seis pontes dissulfeto) e um único sítio de N-glicosilação conservados. A árvore filogenética construída indica maior grau de parentesco com a ordem elopiformes e clupeiformes. A estrutura do heterodímero é majoritariamente polar, com predominância de folhas-beta na sua estrutura secundária, sendo uma citocina com nó de cistina (CATH 2.10.90.10). Os estudos de dinâmica molecular da interação do TSH com receptor do seu ancestral comum, Aruanã-dourado (S. formosus), ambos resolvidos por Alphafold, apontam valores comparáveis ao modelo humano, com diferença de valores relacionados a energia de ligação (ΔG) entre 1,50-8,64%, indicando um caminho para estudos in vitro e in vivo. Sua expressão, feita de maneira transiente, obteve rendimento de agTSH 25 mg/L, similar a trabalho anterior com agFSH 28 mg/L, quantificados através de técnicas cromatográficas no meio condicionado. Conclusões: A região codificante e 3' não traduzida da subunidade beta foi identificada e utilizada juntamente com a subunidade alfa para a produção de agTSH em células HEK293. A metodologia utilizada poderá ser aplicada para que novas proteínas da espécie sejam descritas. Muito embora ainda requeria otimização para aumento da expressão, este trabalho contribuirá para que futuros estudos explorem sua atividade biológica, investigando a eficiência quanto à reprodução e melhoria da capacidade reprodutiva em cativeiro do pirarucu.
Palavras-Chave: pituitary hormones; organic compounds; tsh; fishes; mammals; thyroid hormones; endocrine glands; disturbances; amazon river; biochemistry; structural models; polymerase chain reaction; rna polymerases; artificial intelligence; expert systems; detection
. Bioquímica estrutural da tireotrofina de Arapaima gigas e sua expressão em células de mamífero. Orientador: Carlos Roberto Jorge Soares. 2022. 133 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2022.tde-08112022-105344. Disponível em: http://repositorio.ipen.br/handle/123456789/33609. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Caracterização da estrutura oligossacarídica de prolactina glicosilada humana (G-hPRL) nativa e recombinante / Characterization of the oligosaccharide structure of human glycosylated prolactin (G-hPRL) native and recombinant . 2013. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 81 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2013.tde-04072013-161538 Abstract: A prolactina humana (hPRL) é um hormônio polipeptídico secretado pela hipófise anterior sob regulação do hipotálamo, envolvido em uma variedade de processos biológicos como o desenvolvimento da glândula mamária e lactação. O produto recombinante é importante no diagnóstico médico e no tratamento de insuficiência da lactação. Este hormônio pode ocorrer sob a forma de proteína não glicosilada (NG-hPRL) e glicosilada (G-hPRL), com pesos moleculares de aproximadamente 23 e 25 kilodalton (kDa), respectivamente; possui um único sítio de N-glicosilação localizado na asparagina (Asn) posição 31, que é parcialmente ocupado, representando assim um modelo particularmente interessante de glicosilação. A atividade biológica da G-hPRL é muito menor comparada à NG-hPRL (~4 vezes) e sua função fisiológica ainda não é bem definida: a porção de carboidrato parece ter um importante papel na biossíntese, secreção, atividade biológica, e sobrevivência plasmática do hormônio. O objetivo principal desse trabalho foi comparar as estruturas dos N-glicanos presentes na prolactina glicosilada hipofisária (G-hPRL-NHPP) com a recombinante. Para obter a G-hPRL recombinante foi realizada uma produção em escala laboratorial a partir de células de ovário de hamster chinês (CHO) geneticamente modificadas e adaptadas ao crescimento em suspensão. Foi adicionada, ao meio de cultura cicloheximida (CHX), cujo efeito principal foi aumentar a relação G-hPRL/NGhPRL que passou de 5% para 38%, facilitando assim a purificação da G-hPRL. A G-hPRL foi purificada em duas etapas, uma troca catiônica seguida de purificação por cromatografia liquida de alta eficiência de fase reversa (RP-HPLC) que se demonstrou eficiente na separação das duas isoformas de hPRL. A G-hPRL recombinante IPEN foi assim analisada por diversas técnicas confirmando a sua pureza e atividade biológica, incluindo comparações com outras amostras de referências de origem hipofisária adquirida junto ao National Hormone & Peptide Program (NHPP-E.U.A.) . Foi realizada também a determinação inédita de Nglicanos presentes na G-hPRL produzida por células CHO e na G-hPRL nativa, produzida pela hipófise humana, possibilitando comparar as duas estruturas de carboidratos e alcançando assim uma das principais metas desse projeto. Entre as principais diferenças encontradas nas estruturas dos dois N-glicanos, destacam-se a baixa quantidade de ácido siálico (NeuAc), a alta porcentagem de glicanos sulfatos (74,0%) e com fucose (Fuc) (93,3%) presentes na amostra hipofisária e a tendência da preparação recombinante de apresentar glicanos com maior peso molecular e com uma menor variação nas isoformas.
Palavras-Chave: lth; hormones; mammary glands; lactation; recombinant dna; oligosaccharides; pituitary hormones; cho cells; high-performance liquid chromatography
. Caracterização da estrutura oligossacarídica de prolactina glicosilada humana (G-hPRL) nativa e recombinante. Orientador: Carlos Roberto Jorge Soares. 2013. 81 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2013.tde-04072013-161538. Disponível em: http://repositorio.ipen.br/handle/123456789/10212. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Caracterização físico-química da foliculotrofina humana (hFSH) recombinante e de suas subunidades, por cromatografia líquida de alta eficiência (HPLC) em fase reversa: comparação com a preparação de referência de hFSH de origem hipofisária do 'National Hormone and Pituitary Program' dos EUA. 2006. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. p. Orientador: Maria Teresa de Carvalho Pinto Ribela. DOI: 10.11606/D.85.2006.tde-30032012-100440 Abstract: Um método de cromatografia líquida de alta eficiência por fase reversa (RP-HPLC) para análise qualitativa e quantitativa do hormônio folículo estimulante humano íntegro (hFSH), foi estabelecido e validado quanto à exatidão, precisão e sensibilidade. O FSH humano é um hormônio glicoprotéico dimérico largamente utilizado em medicina reprodutiva tanto para diagnóstico quanto para terapia. A metodologia desenvolvida preserva a integridade da proteína, permitindo a análise da forma heterodimérica intacta, e não somente de suas subunidades, como é normalmente obtida na maioria das condições geralmente empregadas. Esta técnica foi também utilizada para a comparação da hidrofobicidade relativa de preparações de hFSH hipofisária, urinária e derivadas de células de ovário de hamster chinês (CHO) bem como de outros dois hormônios glicoprotéicos, sintetizados na hipófise anterior: hormônio humano estimulante da tireóide (hTSH) e hormônio luteinizante humano (hLH). O menos hidrofóbico dos três hormônios analisados foi o hFSH, seguido do hTSH e do hLH. Uma diferença significativa (p<0,005) foi observada entre o tempo de retenção (tR) das preparações hipofisária e recombinante de hFSH, refletindo diferenças estruturais nas suas cadeias de carboidratos. Duas isoformas principais foram detectadas no hFSH urinário, incluindo uma forma que foi significativamente diferente (p<0,005) das preparações hipofisária e recombinante. Foram demonstradas linearidade da curva dose-resposta (r=0,9965, n=15) para esta metodologia de RP-HPLC, bem como uma precisão inter-ensaio, cujo coeficiente de variação é menor que 4%, para a quantificação de diferentes preparações de hFSH e uma sensibilidade da ordem de 40 ng. Foram também analisados o comportamento cromatográfico e a hidrofobicidade relativa das subunidades individuais das preparações recombinantes e hipofisária de hFSH. Além disso, a exata massa molecular das subunidades individuais de hFSH e do heterodímero foram simultaneamente determinadas por espectrometria de massa MALDI-TOF. A presente metodologia representa, em nossa opinião, uma ferramenta essencial para a caracterização e controle de qualidade deste hormônio, que ainda não consta das principais farmacopéias.
Palavras-Chave: fsh; tsh; experimental data; liquid column chromatography; gonadotropins; pituitary hormones
. Caracterização físico-química da foliculotrofina humana (hFSH) recombinante e de suas subunidades, por cromatografia líquida de alta eficiência (HPLC) em fase reversa: comparação com a preparação de referência de hFSH de origem hipofisária do 'National Hormone and Pituitary Program' dos EUA. Orientador: Maria Teresa de Carvalho Pinto Ribela. 2006. f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. DOI: 10.11606/D.85.2006.tde-30032012-100440. Disponível em: http://repositorio.ipen.br/handle/123456789/11467. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Characterization of the isohormones and other proteins in eluates from the chromatographic purification of human growth hormone (HGH). In: 8th REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA, 18-21 abr, 1979, Caxambu, MG, Brasil. Abstract... 1979. Observação: arquivo não disponível no Repositório
Palavras-Chave: chromatography; electrophoresis; molecular weight; pituitary hormones; sth
. Characterization of the isohormones and other proteins in eluates from the chromatographic purification of human growth hormone (HGH). In: 8th REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA, 18-21 abr, 1979, Caxambu, MG, Brasil. Abstract... 1979. Disponível em: http://repositorio.ipen.br/handle/123456789/20672. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Comparative studies of pituitary (NIDDK, USA) and recombinant (Thyrogen and IPEN) human thyroid stimulating hormone (hTSH) for what concerns cabohydrate structures and charge heterogeneity. In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 35., 1-4 de julho, 2006, Aguas de Lindoia, SP. Resumos... 2006.
Palavras-Chave: pituitary hormones; tsh; trh; cho cells; recombination; carbohydrates; oligosaccharides
. Comparative studies of pituitary (NIDDK, USA) and recombinant (Thyrogen and IPEN) human thyroid stimulating hormone (hTSH) for what concerns cabohydrate structures and charge heterogeneity. In: REUNIAO ANUAL DA SOCIEDADE BRASILEIRA DE BIOQUIMICA E BIOLOGIA MOLECULAR, 35., 1-4 de julho, 2006, Aguas de Lindoia, SP. Resumos... 2006. Disponível em: http://repositorio.ipen.br/handle/123456789/22560. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. A comparison between the oligosaccharide structures of native and recombinant glycosylated human prolactin obtained from CHO cells. In: PROTEIN EXPRESSION IN ANIMAL CELLS CONFERENCE, 11th, September 22-26, 2013, Kananaskis, Alberta, Canada. Abstract... 2013. p. 161.
Palavras-Chave: lth; hormones; mammary glands; lactation; oligosaccharides; pituitary hormones; cho cells; high-performance liquid chromatography
. A comparison between the oligosaccharide structures of native and recombinant glycosylated human prolactin obtained from CHO cells. In: PROTEIN EXPRESSION IN ANIMAL CELLS CONFERENCE, 11th, September 22-26, 2013, Kananaskis, Alberta, Canada. Abstract... 2013. p. 161. Disponível em: http://repositorio.ipen.br/handle/123456789/20308. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Effect of charcoal-treated bovine follicular fluid on the secretion of FSH in ovariectomized and intact prepubertal heifers / Efeito do líquido folicular bovino tratado com carvão ativado na secreção de FSH em novilhas pré-púberes intatas e ovariectomizadas. Brazilian Journal of Veterinary Research and Animal Science, v. 35, n. 5, p. 215-217, 1998. DOI: 10.1590/S1413-95961998000500004
Palavras-Chave: cattle; fsh; ovaries; charcoal; pituitary hormones; activated carbon; hormones
. Effect of charcoal-treated bovine follicular fluid on the secretion of FSH in ovariectomized and intact prepubertal heifers. Brazilian Journal of Veterinary Research and Animal Science, v. 35, n. 5, p. 215-217, 1998. DOI: 10.1590/S1413-95961998000500004. Disponível em: http://repositorio.ipen.br/handle/123456789/7842. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Efficient isolation of the subunits of recombinant and pituitary glycoprotein. Journal of Chromatography, A, v. 1216, n. 9, p. 1431-1438, 2009.
Palavras-Chave: fsh; luteinizing hormone; tsh; pituitary gland; pituitary hormones; recombinant dna; high-performance liquid chromatography
. Efficient isolation of the subunits of recombinant and pituitary glycoprotein. Journal of Chromatography, A, v. 1216, n. 9, p. 1431-1438, 2009. Disponível em: http://repositorio.ipen.br/handle/123456789/7987. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Evaluation of the gonadotropic responsiveness of the pituitary to acute and prolonged administration of LH/FSH-releasing hormone (LHRH) in untreated patients with congenital adrenal hyperplasia. Metabolism - Clinical and Experimental, v. 30, n. 10, p. 976-981, 1981.
Palavras-Chave: hormones; sex; gonadotropins; pituitary hormones; ovaries; biopsy; adrenal glands; pathology; gynecology; biomedical radiography
. Evaluation of the gonadotropic responsiveness of the pituitary to acute and prolonged administration of LH/FSH-releasing hormone (LHRH) in untreated patients with congenital adrenal hyperplasia. Metabolism - Clinical and Experimental, v. 30, n. 10, p. 976-981, 1981. Disponível em: http://repositorio.ipen.br/handle/123456789/7964. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Growth hormone (GH) response to growth hormone-releasing peptide-2 in GH-deficient little mouse. Arquivos Brasileiros de Endocrinologia e Metabologia, v. 51, n. 3, p. p. S122, 2007.
Palavras-Chave: sth; liberins; peptides; pituitary hormones; mice
. Growth hormone (GH) response to growth hormone-releasing peptide-2 in GH-deficient little mouse. Arquivos Brasileiros de Endocrinologia e Metabologia, v. 51, n. 3, p. p. S122, 2007. Disponível em: http://repositorio.ipen.br/handle/123456789/8778. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Growth hormone response to growth hormone-releasing peptide-2 in growth hormone-deficient little mice. Clinics, v. 67, n. v. 3, p. 265-272, 2012.
Palavras-Chave: sth; liberins; peptide hormones; leptin; mice; pituitary hormones
. Growth hormone response to growth hormone-releasing peptide-2 in growth hormone-deficient little mice. Clinics, v. 67, n. v. 3, p. 265-272, 2012. Disponível em: http://repositorio.ipen.br/handle/123456789/8298. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015 Abstract: Prolactin is a pituitary hormone that is involved diverse physiological functions, such as lactation, reproduction, metabolism, osmoregulation, immunoregulation, and behavior. Its level of glycosylation is low in vivo, which favors its expression in bacterial systems. In the present work recombinant human prolactin (rec-hPRL) was expressed from the p1813-hPRL vector in Escherichia coli strain in inclusion bodies with 530.67 mg of rec-hPRL per liter of induced bacterial culture. The solubilization and renaturation of rec-hPRL followed by two methods described in the literature for this protein: one with detergent and basic pH, and other urea and dialyses was done by studying. The protocol with detergent/basic pH was not successful, whereas protocol with urea/dialyses was obtained pure protein and this was optimized. Rec-hPRL was obtained in a soluble, pure and active form, when the sample was 8-fold concentrated in the solubilization phase, allowing 33% recovery, 3-fold more that the original method. The pure protein was obtained with 38.37 i. u./mg activity, which is three times greater than that of the PRL standard from the WHO. In conclusion, this work obtained the highest production of rechPRL, and concentrating the sample eight times in the solubilization stage was decisive for obtaining a highly concentrated, active protein for future work.
Palavras-Chave: lth; hormones; biological effects; bacteria; proteins; in vitro; bioassay; statistical data; lactogens; pituitary hormones; biotechnology
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015. Disponível em: http://repositorio.ipen.br/handle/123456789/29259. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. HPLC analysis of human pituitary hormones for pharmaceutical applications. Current Pharmaceutical Analysis, v. 2, p. 103-126, 2006.
Palavras-Chave: high-performance liquid chromatography; pituitary hormones; impurities; stability; drugs; safety
. HPLC analysis of human pituitary hormones for pharmaceutical applications. Current Pharmaceutical Analysis, v. 2, p. 103-126, 2006. Disponível em: http://repositorio.ipen.br/handle/123456789/7691. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Isolation and characterization of the Arapaima gigas growth hormone (ag-GH) cDNA and three-dimensional modeling of this hormone in comparison with the human hormone (hGH). Biomolecules, v. 13, n. 1, p. 1-17, 2023. DOI: 10.3390/biom13010158 Abstract: In a previous work, the common gonadotrophic hormone α-subunit (ag-GTHα), the ag-FSH β- and ag-LH β-subunit cDNAs, were isolated and characterized by our research group from A. gigas pituitaries, while a preliminary synthesis of ag-FSH was also carried out in human embryonic kidney 293 (HEK293) cells. In the present work, the cDNA sequence encoding the ag-growth hormone (ag-GH) has also been isolated from the same giant Arapaimidae Amazonian fish. The ag-GH consists of 208 amino acids with a putative 23 amino acid signal peptide and a 185 amino acid mature peptide. The highest identity, based on the amino acid sequences, was found with the Elopiformes (82.0%), followed by Anguilliformes (79.7%) and Acipenseriformes (74.5%). The identity with the corresponding human GH (hGH) amino acid sequence is remarkable (44.8%), and the two disulfide bonds present in both sequences were perfectly conserved. Three-dimensional (3D) models of ag-GH, in comparison with hGH, were generated using the threading modeling method followed by molecular dynamics. Our simulations suggest that the two proteins have similar structural properties without major conformational changes under the simulated conditions, even though they are separated from each other by a >100 Myr evolutionary period (1 Myr = 1 million years). The sequence found will be used for the biotechnological synthesis of ag-GH while the ag-GH cDNA obtained will be utilized for preliminary Gene Therapy studies.
Palavras-Chave: fishes; pituitary hormones; gonadotropins; molecules; cloning; dna sequencing
. Isolation and characterization of the Arapaima gigas growth hormone (ag-GH) cDNA and three-dimensional modeling of this hormone in comparison with the human hormone (hGH). Biomolecules, v. 13, n. 1, p. 1-17, 2023. DOI: 10.3390/biom13010158. Disponível em: http://repositorio.ipen.br/handle/123456789/33977. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Molecular cloning and characterization of pirarucu (Arapaima gigas) follicle-stimulating hormone and luteinizing hormone β-subunit cDNAs. Plos One, v. 12, n. 8, p. 1-22, 2017. DOI: 10.1371/journal.pone.0183545 Abstract: The common gonadotrophic hormone α-subunit (GTHα) has been previously isolated by our research group from A. gigas pituitaries; in the present work the cDNA sequences encoding FSHβ and LHβ subunits have also been isolated from the same species of fish. The FSH β-subunit consists of 126 amino acids with a putative 18 amino acid signal peptide and a 108 amino acid mature peptide, while the LH β-subunit consists of 141 amino acids with a putative 24 amino acid amino acid signal peptide and a 117 amino acid mature peptide. The highest identity, based on the amino acid sequences, was found with the order of Anguilliformes (61%) for FSHβ and of Cypriniformes (76%) for LHβ, followed by Siluriformes, 53% for FSHβ and 75% for LHβ. Interestingly, the identity with the corresponding human amino acid sequences was still remarkable: 45.1% for FSHβ and 51.4% for LHβ. Three dimensional models of ag-FSH and ag-LH, generated by using the crystal structures of h-FSH and h-LH as the respective templates and carried out via comparative modeling and molecular dynamics simulations, suggested the presence of the so-called ªseat-beltº, favored by a disulfide bond formed between the 3rd and 12th cysteine in both β-subunits. The sequences found will be used for the biotechnological synthesis of A. gigas gonadotrophic hormones (ag-FSH and ag-LH). In a first approach, to ascertain that the cloned transcripts allow the expression of the heterodimeric hormones, ag-FSH has been synthesized in human embryonic kidney 293 (HEK293) cells, preliminarily purified and characterized.
Palavras-Chave: hormones; pituitary gland; pituitary hormones; gonadotropins; fishes; luteinizing hormone; dna-cloning; molecular models
. Molecular cloning and characterization of pirarucu (Arapaima gigas) follicle-stimulating hormone and luteinizing hormone β-subunit cDNAs. Plos One, v. 12, n. 8, p. 1-22, 2017. DOI: 10.1371/journal.pone.0183545. Disponível em: http://repositorio.ipen.br/handle/123456789/28167. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. A molecular mimic demonstrates that phosphorylated human prolactin is a potent anti-angiogenic hormone. Endocrine-Related Cancer, v. 13, n. 1, p. 95-111, 2006.
Palavras-Chave: lth; phosphorylation; pituitary hormones; neoplasms; apoptosis; growth factors; promoters
. A molecular mimic demonstrates that phosphorylated human prolactin is a potent anti-angiogenic hormone. Endocrine-Related Cancer, v. 13, n. 1, p. 95-111, 2006. Disponível em: http://repositorio.ipen.br/handle/123456789/7689. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. N-glycoprofiling analysis in a simple glycoprotein model: glycosylated human prolactin. Journal of Biotechnology, v. 185, p. S29, 2014.
Palavras-Chave: biotechnology; lth; molecular structure; comparative evaluations; animals; mice; glycoproteins; pituitary hormones
. N-glycoprofiling analysis in a simple glycoprotein model: glycosylated human prolactin. Journal of Biotechnology, v. 185, p. S29, 2014. Disponível em: http://repositorio.ipen.br/handle/123456789/26402. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-20 de 38
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

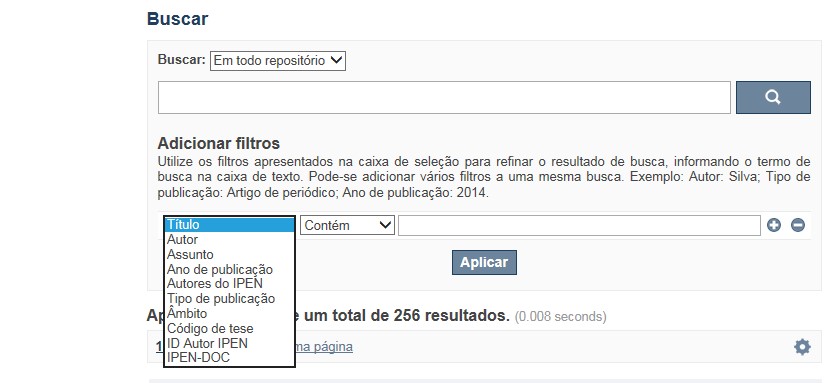
A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
