Navegação por assunto "protein structure"
- Página inicial
- →
- Navegação por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação por assunto "protein structure"
Itens para a visualização no momento 1-9 de 9
-
. Influencia das principais especies reativas formadas durante o processo de destoxicacao de toxinas por radiacao ionizante. 2003. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, São Paulo. 73 p. Orientador: Nanci do Nascimento.
Palavras-Chave: venoms; snakes; toxins; detoxification; ionizing radiations; radiation effects; radiolysis; protein structure; gamma radiation; cobalt 60
. Influencia das principais especies reativas formadas durante o processo de destoxicacao de toxinas por radiacao ionizante. Orientador: Nanci do Nascimento. 2003. 73 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, São Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/11098. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Obtenção, caracterizações estruturais e atividade enzimática do sítio C-catalítico da enzima conversora de angiotensina I - região ALAsup(959) até SERsup(1066) / Obtaining, structural characterization and enzymatic activity of the C catalytic site of angiotensin convertin enzyme I ALA959 to SER1066 region . 2015. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 63 p. Orientador: Regina Affonso. DOI: 10.11606/D.85.2015.tde-23112015-083845 Abstract: A enzima conversora de angiotensina (ECA) catalisa a conversão de angiotensina I (Ang I) no vasoconstritor angiotensina II (Ang II) e hidrolisa a bradicinina (BK). ECA somática (sECA) possui dois domínios homólogos (N e C) que têm 60% de identidade. Embora estas duas regiões tenham homologia grande, o sítio catalítico C-domínio exibe uma atividade três vezes maior do que o N-domínio na hidrolise de Ang I in vivo. Este fato torna interessante o desenvolvimento de novos estudos de inibidores ou a melhoria dos já existentes. O objetivo deste estudo foi obter a região Ala959 até Ser1066 do Cdomínio da sECA (c-sECA), em uma estrutura conformacional semelhante à estrutura nativa. Nós amplificamos a sequência correspondente ao sítio catalítico da c-sECA com 324pb e clonamos esta sequência no vetor pET 28a(+). O segmento (nomeado de pET28_c-sECA) foi expresso em sistema bacteriano. A proteína foi expressa na forma solúvel e a purificação foi feita em uma única etapa utilizando a coluna de afinidade His-tag, a qual produziu a proteína pura. Análises estruturais por dicroísmo circular e fluorescência confirmaram que a proteína recombinante estava na conformação correta, e os ensaios de atividade mostraram que a c-sECA possui atividade enzimática e é inibida por lisinopril.
Palavras-Chave: cardiovascular diseases; cardiovascular system; blood circulation; hypertension; enzyme inhibitors; enzyme activity; angiotensin; dna; escherichia coli; protein structure; molecular biology
. Obtenção, caracterizações estruturais e atividade enzimática do sítio C-catalítico da enzima conversora de angiotensina I - região ALAsup(959) até SERsup(1066). Orientador: Regina Affonso. 2015. 63 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2015.tde-23112015-083845. Disponível em: http://repositorio.ipen.br/handle/123456789/25320. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Protein identification from the parotoid macrogland secretion of Duttaphrynus melanostictus. Journal of Venomous Animals and Toxins including Tropical Diseases, v. 25, p. 1-12, 2019. DOI: 10.1590/1678-9199-JVATITD-2019-0029 Abstract: Background: Bufonid parotoid macrogland secretion contains several low molecular mass molecules, such as alkaloids and steroids. Nevertheless, its protein content is poorly understood. Herein, we applied a sample preparation methodology that allows the analysis of viscous matrices in order to examine its proteins. Methods: Duttaphrynus melanostictus parotoid macrogland secretion was submitted to ion-exchange batch sample preparation, yielding two fractions: salt-displaced fraction and acid-displaced fraction. Each sample was then fractionated by anionic-exchange chromatography, followed by in-solution proteomic analysis. Results: Forty-two proteins could be identified, such as acyl-CoA-binding protein, alcohol dehydrogenase, calmodulin, galectin and histone. Moreover, de novo analyses yielded 153 peptides, whereas BLAST analyses corroborated some of the proteomicidentified proteins. Furthermore, the de novo peptide analyses indicate the presence of proteins related to apoptosis, cellular structure, catalysis and transport processes. Conclusions: Proper sample preparation allowed the proteomic and de novo identification of different proteins in the D. melanostictus parotoid macrogland secretion. These results may increase the knowledge about the universe of molecules that compose amphibian skin secretion, as well as to understand their biological/physiological role in the granular gland.
Palavras-Chave: proteins; secretion; amphibians; frogs; glands; skin; protein structure; chromatography; spectroscopy
. Protein identification from the parotoid macrogland secretion of Duttaphrynus melanostictus. Journal of Venomous Animals and Toxins including Tropical Diseases, v. 25, p. 1-12, 2019. DOI: 10.1590/1678-9199-JVATITD-2019-0029. Disponível em: http://repositorio.ipen.br/handle/123456789/30470. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Protein profile analysis of two australian snake venoms by one- dimensional gel electrophoresis and MS/MS experiments. Current Medicinal Chemistry, v. 24, n. 17, p. 1892-1908, 2017. DOI: 10.2174/0929867324666170601073148 Abstract: The Pseudechis colletti and Pseudechis butleri venoms were analyzed by 1-D gel electrophoresis, followed by mass spectrometric analysis of tryptic peptides obtained from the protein bands. Both venoms contain highly potent pharmacologically active components, which were assigned to the following protein families: basic and acidic phospholipases A2 (PLA2s), L-amino acid oxidases (LAAOs), P-III metalloproteinases (P-III SVMPs), 5’- nucleotidases (5’-NTDs), cysteine-rich secretory proteins (CRISPs), venom nerve growth factors (VNGFs) and post-synaptic neurotoxins. Considerable predominance of PLA2s over other toxins is a characteristic feature of both venoms. The major differences in the venom compositions are the higher concentration of SVMPs and CRISPs in the P. butleri venom, as well as the presence of post-synaptic neurotoxins. Furthermore, the analysis revealed a high concentration of proteins with myotoxic, coagulopathic and apoptotic activities. PLA2s are responsible for the myotoxic and anticoagulant effects observed in patients after envenomation (4). The other protein families, encountered in the two venoms, probably contribute to the major symptoms described for these venoms. These results explain the observed clinical effects of the black snake envenomation. The analyzed venoms contain group P-III metalloproteinases of medical importance with the potency to be used for diagnostic purposes of von Willebrand factor (vWF) disease, for regulation of vWF in thrombosis and haemostasis, for studying the function of the complement system in host defense and in the pathogenesis of diseases. Comparison of venomic data showed similarities in the major venom components of snakes from the genus Pseudechis, resulting in common clinical effects of envenomation, and demonstrating close relationships between venom toxins of Elapidae snakes.
Palavras-Chave: proteins; protein structure; snakes; venoms; electrophoresis; pharmacology; mass spectroscopy; australia
. Protein profile analysis of two australian snake venoms by one- dimensional gel electrophoresis and MS/MS experiments. Current Medicinal Chemistry, v. 24, n. 17, p. 1892-1908, 2017. DOI: 10.2174/0929867324666170601073148. Disponível em: http://repositorio.ipen.br/handle/123456789/27743. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Protein refolding at high pressure: Optimization using eGFP as a model. Process Biochemistry, v. 46, n. 2, p. 512-518, 2011.
Palavras-Chave: protein structure; pressure dependence; pressure range mega pa 10-100; fluorescence; body; agglomeration
. Protein refolding at high pressure: Optimization using eGFP as a model. Process Biochemistry, v. 46, n. 2, p. 512-518, 2011. Disponível em: http://repositorio.ipen.br/handle/123456789/8180. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Proteomic analysis of soluble proteins retrieved from Duttaphrynus melanostictus skin secretion by IEx-batch sample preparation. Journal of Proteomics, v. 209, p. 1-24, 2019. DOI: 10.1016/j.jprot.2019.103525 Abstract: Amphibians display a toxic secretion that works as chemical defenses against predators and/or microorganisms that is stored in specialized glands located in the tegument. For some animals, such glands have accumulated in specific regions of the body and formed prominent structures known as macroglands. The Bufonidae family displays conspicuous macroglands in a post-orbital position, termed parotoids, which secretions are known to be extremely viscous and rich in alkaloids and steroids. Few proteins have been described in this material, though. Mainly, because of the difficulties to handle such biological matrix. In this context, we have performed a proteomic study on the parotoid macrogland secretion of the Asian bufonid Duttaphrynus melanostictus. By employing the Ion-Exchange (IEx)-batch chromatography (anionic, cationic and both) we obtained six fractions - bound and unbound – that were submitted to an in solution-trypsin digestion followed by LC-MS/MS. Proteins related to: antioxidant activity, binding processes (carbohydrate/lipid/protein), energy metabolism, hydrolases, lipid metabolism and membrane traffic were identified. Moreover, IEx was able to preserve the biological activity of the retrieved proteins (peptidasic). The current study increases the knowledge on the proteins present in the bufonids parotoid macrogland secretion, providing a better understanding of the physiological role played by such molecules. Significance: The current approach allowed a detailed proteomic analysis of the several proteins synthesized in the D. melanostictus parotoid macrogland (Bufonidae) that are secreted into the skins, but embedded within a complex viscous biological matrix. Moreover, our results aim to increase the knowledge on the biological role played by such proteins at the skin.
Palavras-Chave: amphibians; skin; secretion; ion exchange chromatography; protein structure; structural chemical analysis; animal tissues; solubility; frogs
. Proteomic analysis of soluble proteins retrieved from Duttaphrynus melanostictus skin secretion by IEx-batch sample preparation. Journal of Proteomics, v. 209, p. 1-24, 2019. DOI: 10.1016/j.jprot.2019.103525. Disponível em: http://repositorio.ipen.br/handle/123456789/30471. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Recombinant PilS: cloning, expression and biochemical characterization of a Pil-fimbriae subunit. Microorganisms, v. 10, n. 6, p. 1-17, 2022. DOI: 10.3390/microorganisms10061174 Abstract: Pil-fimbriae is a type IV pili member, which is a remarkably versatile component with a wide variety of functions, including motility, attachment to different surfaces, electrical conductance, DNA acquisition, and secretion of a broad range of structurally distinct protein substrates. Despite the previous functional characterization of Pil, more studies are required to understand the regulation of Pil expression and production, since the exact mechanisms involved in these steps are still unknown. Therefore it is extremely important to have a protein with the correct secondary and tertiary structure that will enable an accurate characterization and a specific antisera generation. For this reason, the aim of this work was to generate potential tools for further investigations to comprehend the mechanisms involved in Pil regulation and its role in pathogenic E. coli infections with the obtaining of a precise native-like recombinant PilS and the corresponding antisera. The pilS gene was successfully cloned into an expression vector, and recombinant PilS (rPilS) was efficiently solubilized and purified by metal affinity chromatography. Protein characterization analyses indicated that rPilS presented native-like secondary and tertiary structures after the refolding process. The generated anti-rPilS sera efficiently recognized recombinant and native proteins from atypical enteropathogenic E. coli strains.
Palavras-Chave: proteins; protein structure; recombinant dna; biochemistry; cloning
. Recombinant PilS: cloning, expression and biochemical characterization of a Pil-fimbriae subunit. Microorganisms, v. 10, n. 6, p. 1-17, 2022. DOI: 10.3390/microorganisms10061174. Disponível em: http://repositorio.ipen.br/handle/123456789/33196. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Structural studies of the protein endostatin in fusion with BAX BH3 death domain, a hybrid that presents enhanced antitumoral activity. Biotechnology and Applied Biochemistry, v. 64, n. 3, p. 356-363, 2017. DOI: 10.1002/bab.1503 Abstract: Endostatin (ES) is an antiangiogenic protein that exhibits antitumor activity in animal models. However, the activity observed in animals was not observed in human clinical trials. ES-BAX is a fusion protein composed of two functional domains: ES, which presents specificity and is internalized by activated endothelial cells and the proapoptotic BH3 domain of the protein BAX, a peptide inductor of cellular death when internalized. We have previously shown (Chura-Chambi et al., Cell Death Dis, 5, e1371, 2014) that ES-BAX presents improved antitumor activity in relation to wild-type ES. Secondary and tertiary structures of ES-BAX are similar to ES, as indicated by homology-modeling studies and molecular dynamics simulations. Tryptophan intrinsic fluorescence and circular dichroism spectroscopy corroborate these data. 15N HSQC NMR indicates that ES-BAX is structured, but some ES residues have suffered chemical shift perturbations, suggesting that the BH3 peptide interacts with some parts of the ES protein. ES and ES-BAX present similar stability to thermal denaturation. The production of stable hybrid proteins can be a new approach to the development of therapeutic agents presenting specificity for tumoral endothelium and improved antitumor effect.
Palavras-Chave: molecular structure; protein structure; angiogenesis; apoptosis; dichroism; simulation; purification; electrophoresis; fluorescence spectroscopy
. Structural studies of the protein endostatin in fusion with BAX BH3 death domain, a hybrid that presents enhanced antitumoral activity. Biotechnology and Applied Biochemistry, v. 64, n. 3, p. 356-363, 2017. DOI: 10.1002/bab.1503. Disponível em: http://repositorio.ipen.br/handle/123456789/26990. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Study of DNA and protein structures through perturbed angular correlations. In: REUNIAO DE TRABALHO SOBRE FISICA NUCLEAR NO BRASIL, 28., 7-11 de setembro, 2005, Guaruja, SP. Anais... 2005. p. 209-220.
Palavras-Chave: perturbed angular correlation; dna; protein structure
. Study of DNA and protein structures through perturbed angular correlations. In: REUNIAO DE TRABALHO SOBRE FISICA NUCLEAR NO BRASIL, 28., 7-11 de setembro, 2005, Guaruja, SP. Anais... 2005. p. 209-220. Disponível em: http://repositorio.ipen.br/handle/123456789/15823. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-9 de 9
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
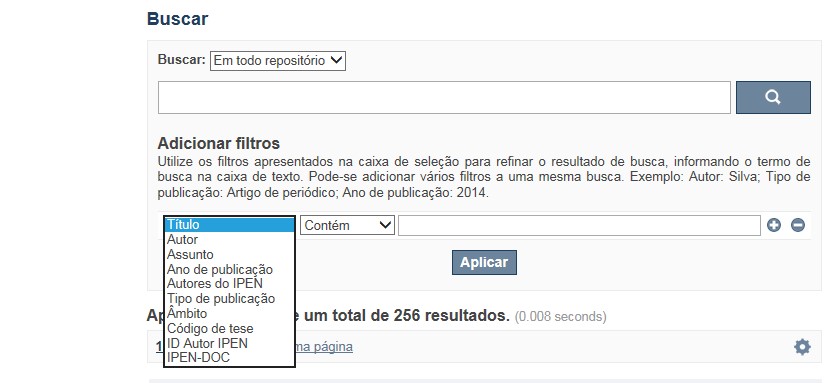
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
