Navegação IPEN por Revista "Protein Expression and Purification"
- Página inicial
- →
- IPEN
- →
- Navegação IPEN por Revista
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação IPEN por Revista "Protein Expression and Purification"
Itens para a visualização no momento 1-8 de 8
-
. Expression, purification and characterization of the authentic form of human growth hormone receptor antagonist G120R-hGH obtained in Escherichia coli periplasmic space. Protein Expression and Purification, v. 131, p. 91-100, 2017. DOI: 10.1016/j.pep.2016.12.001 Abstract: The human growth hormone receptor antagonist G120R-hGH precludes dimerization of GH and prolactin receptors and consequently JAK/STAT signaling. Some modifications in this antagonist resulted in a drug specific for the GH receptor, called Pegvisomant (Somavert®). However, the original G120R-hGH is usually synthesized in bacterial cytoplasm as inclusion bodies, not being a commercial product. The present work describes the synthesis and characterization of G120R-hGH secreted into bacterial periplasm and obtained with a vector based on a constitutive lambda-PL promoter. This antagonist can be useful for studies aiming at investigating the effects of a simultaneous inhibition of GH and prolactin signaling, as a potential anti-tumoral or anti-diabetic compound. G120R-hGH, synthesized using the W3110 E. coli strain, showed a yield of 1.34 ± 0.24 mg/ml/A600 (~0.79 mg G120R-hGH/g of wet weight cells) after cultivation at 30 C up to 3 A600 units and induction at 37 C, for 6 h, with final 4.3 ± 0.3 A600. A laboratory scale purification was carried out using three chromatographic steps with a total yield of 32%, reaching 98% purity. The obtained protein was characterized by SDS-PAGE, Western Blotting, Mass spectrometry, RP-HPLC, HPSEC and in vitro proliferation bioassay. The proliferation assay, based on Ba/F3- LLP cells, shows that G120R-hGH (100 ng/ml) significantly inhibited (64%) the proliferative action of hGH (1 ng/ml). This is the first time that G120R-hGH is synthesized in bacterial periplasmic space and therefore correctly folded, without the initial methionine. The reasons for a divergent efficacy for antagonizing hGH versus hPRL is currently unknown and deserves further investigation.
Palavras-Chave: hormones; receptors; escherichia coli; osmosis; growth; dimerization
. Expression, purification and characterization of the authentic form of human growth hormone receptor antagonist G120R-hGH obtained in Escherichia coli periplasmic space. Protein Expression and Purification, v. 131, p. 91-100, 2017. DOI: 10.1016/j.pep.2016.12.001. Disponível em: http://repositorio.ipen.br/handle/123456789/27151. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015 Abstract: Prolactin is a pituitary hormone that is involved diverse physiological functions, such as lactation, reproduction, metabolism, osmoregulation, immunoregulation, and behavior. Its level of glycosylation is low in vivo, which favors its expression in bacterial systems. In the present work recombinant human prolactin (rec-hPRL) was expressed from the p1813-hPRL vector in Escherichia coli strain in inclusion bodies with 530.67 mg of rec-hPRL per liter of induced bacterial culture. The solubilization and renaturation of rec-hPRL followed by two methods described in the literature for this protein: one with detergent and basic pH, and other urea and dialyses was done by studying. The protocol with detergent/basic pH was not successful, whereas protocol with urea/dialyses was obtained pure protein and this was optimized. Rec-hPRL was obtained in a soluble, pure and active form, when the sample was 8-fold concentrated in the solubilization phase, allowing 33% recovery, 3-fold more that the original method. The pure protein was obtained with 38.37 i. u./mg activity, which is three times greater than that of the PRL standard from the WHO. In conclusion, this work obtained the highest production of rechPRL, and concentrating the sample eight times in the solubilization stage was decisive for obtaining a highly concentrated, active protein for future work.
Palavras-Chave: lth; hormones; biological effects; bacteria; proteins; in vitro; bioassay; statistical data; lactogens; pituitary hormones; biotechnology
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015. Disponível em: http://repositorio.ipen.br/handle/123456789/29259. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High-level synthesis of recombinant murine endostatin in chinese hamster ovary cells. Protein Expression and Purification, v. 35, n. 1, p. 11-16, 2004.
Palavras-Chave: cho cells; gene recombination; tumor cells; fibroblasts; purification; clone cells; antibodies
. High-level synthesis of recombinant murine endostatin in chinese hamster ovary cells. Protein Expression and Purification, v. 35, n. 1, p. 11-16, 2004. Disponível em: http://repositorio.ipen.br/handle/123456789/5764. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Investigation on solubilization protocols in the refolding of the thiredoxin TsnC from Xylella fastidiosa by high hydrostatic pressure approach. Protein Expression and Purification, v. 106, p. 72-77, 2015.
Palavras-Chave: proteins; bacteria; escherichia coli; hydrostatics; pressurization; inclusions
. Investigation on solubilization protocols in the refolding of the thiredoxin TsnC from Xylella fastidiosa by high hydrostatic pressure approach. Protein Expression and Purification, v. 106, p. 72-77, 2015. Disponível em: http://repositorio.ipen.br/handle/123456789/22934. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Physico-chemical and biological characterizations of two human prolactin analogs exhibiting controversial bioactivity, synthesized in chinese hamster ovary (CHO) cells. Protein Expression and Purification, v. 48, n. 2, p. 182-194, 2006. DOI: 10.1016/j.pep.2006.04.013
Palavras-Chave: lth; hormones; cho cells; mammary glands; prostaglandins; neoplasms
. Physico-chemical and biological characterizations of two human prolactin analogs exhibiting controversial bioactivity, synthesized in chinese hamster ovary (CHO) cells. Protein Expression and Purification, v. 48, n. 2, p. 182-194, 2006. DOI: 10.1016/j.pep.2006.04.013. Disponível em: http://repositorio.ipen.br/handle/123456789/7693. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. A simple strategy for the purification of native recombinant full-length human RPL10 protein from inclusion bodies. Protein Expression and Purification, v. 101, p. 115-120, 2014.
Palavras-Chave: ribosomes; messenger-rna; cloning; carcinomas; gene therapy; inclusions; folding model; tumor cells; inhibition; fluorescence spectroscopy
. A simple strategy for the purification of native recombinant full-length human RPL10 protein from inclusion bodies. Protein Expression and Purification, v. 101, p. 115-120, 2014. Disponível em: http://repositorio.ipen.br/handle/123456789/23190. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Single-step purification of recombinant human growth hormone (hGH) directly from bacterial osmotic shock fluids, for the purpose of sup(125)I-hGH preparation. Protein Expression and Purification, v. 18, n. 2, p. 115-120, 2000.
Palavras-Chave: sth; recombinant dna; purification; chloramines; iodination; labelling; iodine 125; chromatography; escherichia coli; radioimmunoassay
. Single-step purification of recombinant human growth hormone (hGH) directly from bacterial osmotic shock fluids, for the purpose of sup(125)I-hGH preparation. Protein Expression and Purification, v. 18, n. 2, p. 115-120, 2000. Disponível em: http://repositorio.ipen.br/handle/123456789/6252. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Stable expression of a human-like sialylated recombinant thyrotropin in a chinese hamster ovary cell line expressing 'alfa'2,6-sialyltransferase. Protein Expression and Purification, v. 67, n. 1, p. 7-14, 2009.
Palavras-Chave: cho cells; tsh; trh; ion exchange chromatography; high-performance liquid chromatography; bioassay
. Stable expression of a human-like sialylated recombinant thyrotropin in a chinese hamster ovary cell line expressing 'alfa'2,6-sialyltransferase. Protein Expression and Purification, v. 67, n. 1, p. 7-14, 2009. Disponível em: http://repositorio.ipen.br/handle/123456789/4850. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-8 de 8
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
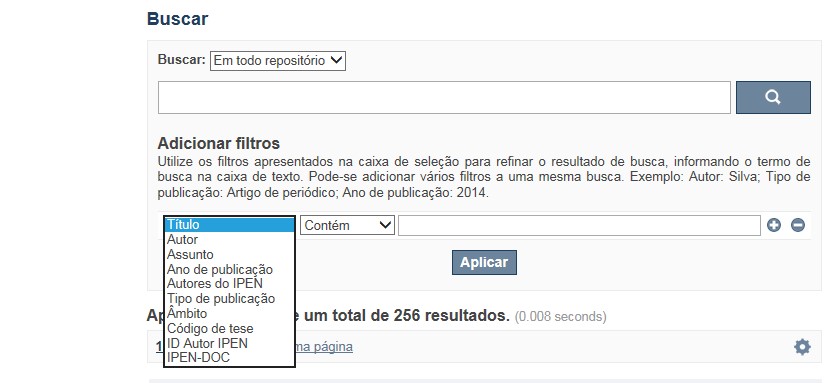
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
