Navegação Periódicos - Artigos por Autores IPEN "AFFONSO, REGINA"
- Página inicial
- →
- IPEN
- →
- Periódicos - Artigos
- →
- Navegação Periódicos - Artigos por Autores IPEN
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação Periódicos - Artigos por Autores IPEN "AFFONSO, REGINA"
Itens para a visualização no momento 1-12 de 12
-
. Adenocarcinoma prostático: análise clínica e epidemiológica / Prostate adenocarcinoma: clinical and epidemiological analysis. Revista da Sociedade Brasileira de Clínica Médica, v. 15, n. 03, p. 178-182, 2017. Abstract: OBJETIVO: Realizar análise clínica e epidemiológica de pacientes com câncer de próstata. MÉTODOS: Estudo retrospectivo, descritivo de 607 prontuários de pacientes com câncer de próstata, atendidos entre 2012 a 2014. As variáveis analisadas foram: procedência, faixa etária, antígeno prostático específico (PSA) total, escore de Gleason da biópsia e da peça cirúrgica. A análise estatística foi realizada com software SPSS, versão 19.0. RESULTADOS: A maioria dos pacientes (57%) era de Ipatinga (MG) e arredores. A faixa etária mais frequente foi de 61 a 80 anos (76,6%). Valores de PSA entre 4,1 a 10ng/mL foram mais frequentes. O escore de Gleason da biópsia revelou que 321 pacientes apresentavam tumor intermediário. Apenas 203 pacientes realizaram a prostectomina, e 61,5% das peças cirúrgicas também apresentaram tumor intermediário. Houve correlação significativa entre as faixas etárias e os níveis de PSA (R2=0,9319), e também entre o nível de PSA e os valores de escore Gleason da biópsia (p<0,05). Houve concordância entre os valores de escore de Gleason da biópsia com os da peça cirúrgica em 72,9% dos casos. CONCLUSÃO: Em nosso conhecimento, este foi o primeiro estudo epidemiológico de câncer de próstata na região do Vale do Aço. As informações fornecidas neste trabalho podem contribuir com programas para desenvolver ações de controle do câncer de próstata nesta região.
Palavras-Chave: carcinomas; prostate; neoplasms; diagnosis; diagnostic techniques; biopsy; epidemiology
. Adenocarcinoma prostático: análise clínica e epidemiológica. Revista da Sociedade Brasileira de Clínica Médica, v. 15, n. 03, p. 178-182, 2017. Disponível em: http://repositorio.ipen.br/handle/123456789/28615. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Gene analysis in patients with premature ovarium failure or gonadal dysgenesis: A preliminary study. Maturitas, v. 57, n. 4, p. 399-404, 2007.
Palavras-Chave: genes; ovaries; failures; gene mutations; gonads
. Gene analysis in patients with premature ovarium failure or gonadal dysgenesis: A preliminary study. Maturitas, v. 57, n. 4, p. 399-404, 2007. Disponível em: http://repositorio.ipen.br/handle/123456789/7817. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Genetic diversity of Pneumocystis jirovecii from a cluster of cases of pneumonia in renal transplant patients: Cross-sectional study. Mycoses, v. 61, n. 11, p. 845-852, 2018. DOI: 10.1111/myc.12823 Abstract: Pneumocystis jirovecii can cause severe potentially life-threatening pneumonia (PCP) in kidney transplant patients. Prophylaxis of patients against PCP in this setting is usually performed during 6 months after transplantation. The aim of this study is to describe the molecular epidemiology of a cluster of PCP in renal transplant recipients in Brazil. Renal transplant patients who developed PCP between May and December 2011 had their formalin-fixed paraffin-embedded (FFPE) lung biopsy samples analysed. Pneumocystis jirovecii 23S mitochondrial large subunit of ribosomal RNA (23S mtLSU-rRNA), 26S rRNA, and dihydropteroate synthase (DHPS) genes were amplified by polymerase chain reaction (PCR), sequenced, and analysed for genetic variation. During the study period, 17 patients developed PCP (only four infections were documented within the first year after transplantation) and six (35.3%) died. Thirty FFPE samples from 11 patients, including one external control HIV-infected patient, had fungal DNA successfully extracted for further amplification and sequencing for all three genes. A total of five genotypes were identified among the 10 infected patients. Of note, four patients were infected by more than one genotype and seven patients were infected by the same genotype. DNA extracted from FFPE samples can be used for genotyping; this approach allowed us to demonstrate that multiple P. jirovecii strains were responsible for this cluster, and one genotype was found infecting seven patients. The knowledge of the causative agents of PCP may help to develop new initiatives for control and prevention of PCP among patients undergoing renal transplant and improve routine PCP prophylaxis.
Palavras-Chave: kidneys; transplants; pneumonia; diseases; genetics; epidemiology; patients; immune system diseases
. Genetic diversity of Pneumocystis jirovecii from a cluster of cases of pneumonia in renal transplant patients: Cross-sectional study. Mycoses, v. 61, n. 11, p. 845-852, 2018. DOI: 10.1111/myc.12823. Disponível em: http://repositorio.ipen.br/handle/123456789/29341. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015 Abstract: Prolactin is a pituitary hormone that is involved diverse physiological functions, such as lactation, reproduction, metabolism, osmoregulation, immunoregulation, and behavior. Its level of glycosylation is low in vivo, which favors its expression in bacterial systems. In the present work recombinant human prolactin (rec-hPRL) was expressed from the p1813-hPRL vector in Escherichia coli strain in inclusion bodies with 530.67 mg of rec-hPRL per liter of induced bacterial culture. The solubilization and renaturation of rec-hPRL followed by two methods described in the literature for this protein: one with detergent and basic pH, and other urea and dialyses was done by studying. The protocol with detergent/basic pH was not successful, whereas protocol with urea/dialyses was obtained pure protein and this was optimized. Rec-hPRL was obtained in a soluble, pure and active form, when the sample was 8-fold concentrated in the solubilization phase, allowing 33% recovery, 3-fold more that the original method. The pure protein was obtained with 38.37 i. u./mg activity, which is three times greater than that of the PRL standard from the WHO. In conclusion, this work obtained the highest production of rechPRL, and concentrating the sample eight times in the solubilization stage was decisive for obtaining a highly concentrated, active protein for future work.
Palavras-Chave: lth; hormones; biological effects; bacteria; proteins; in vitro; bioassay; statistical data; lactogens; pituitary hormones; biotechnology
. High production and optimization of the method for obtaining pure recombinant human prolactin. Protein Expression and Purification, v. 152, p. 131-136, 2018. DOI: 10.1016/j.pep.2018.07.015. Disponível em: http://repositorio.ipen.br/handle/123456789/29259. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. In vitro antibacterial and hemolytic activities of crotamine, a small basic myotoxin from rattlesnake Crotalus durissus. Journal of Antibiotics, v. 64, n. 4, p. 327-331, 2011.
Palavras-Chave: antimicrobial agents; peptides; hemolysis; escherichia coli; snakes; venoms; toxins
. In vitro antibacterial and hemolytic activities of crotamine, a small basic myotoxin from rattlesnake Crotalus durissus. Journal of Antibiotics, v. 64, n. 4, p. 327-331, 2011. Disponível em: http://repositorio.ipen.br/handle/123456789/4426. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Influence of the expression vector and its elements on recombinant human prolactin synthesis in Escherichia coli; co-directional orientation of replication and transcription is highly critical. Journal of Microbiological Methods, v. 191, p. 1-8, 2021. DOI: 10.1016/j.mimet.2021.106340 Abstract: The aim of the present work was to define a bacterial expression system that is particularly efficient for the synthesis of recombinant human prolactin (hPRL). In previous work, based on experiments that were basically carried out in parallel with the present ones, the synthesis of rec-hPRL by the p1813-hPRL vector in E. coli HB2151 was >500 mg/L, while it was much lower here (2.5–4-fold), in the RB791 and RRI strains. The highest positive influence on rec-hPRL synthesis was due to the transcription-replication co-orientation of hPRL cDNA and the ori/antibiotic resistance gene, responsible for up to a ~ 5–6-fold higher expression yield. In conclusion, this work confirmed that each bacterial strain of E. coli has a genetic background that can allow a different level of heterologous protein synthesis. The individual study of each element indicated that its action critically depends on the reading orientation in which it is located inside the vector: co-directional orientation of replication and transcription, in fact, greatly increased the level of rec-hPRL expression
Palavras-Chave: lth; escherichia coli; collisions; plasmids; dna
. Influence of the expression vector and its elements on recombinant human prolactin synthesis in Escherichia coli; co-directional orientation of replication and transcription is highly critical. Journal of Microbiological Methods, v. 191, p. 1-8, 2021. DOI: 10.1016/j.mimet.2021.106340. Disponível em: http://repositorio.ipen.br/handle/123456789/32515. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. A new approach for purification of the catalytic site of the angiotensin-conversion enzyme, N-domain, mediated by the ELP-Intein system. Journal of Pharmacological and Toxicological Methods, v. 116, p. 1-6, 2022. DOI: 10.1016/j.vascn.2022.107174 Abstract: Angiotensin-converting enzyme I (ACE) is a key part of the renin-angiotensin system. Its main function is to regulate blood pressure and the balance of salts in the body. Somatic ACE has two domains, N-C-, each of which has a catalytic site that exhibits 60%sequence identity. The N-domain has a specific action in the hydrolysis of beta-amyloid bodies and angiotensin (1–7), which activates the MAS receptor and triggers anti-thrombotic and anti-inflammatory actions. Our goal was to obtain the catalytic site Ala361 to Gly468 of the N domain region, csACEN, without needing purification by chromatography. We employed a method that uses an Elastin-like Polypeptide (ELP) and Intein sequences linked to the peptide of interest. The more differential for obtaining the pure peptide was the cultivation temperatures in the synthesis of ELPcsACEN at 37 °C, with a significant increase in expression. In the purification by ELP precipitation, we recorded the highest efficiency in the concentrations of 0.57 M and 0.8 M of ammonium sulfate buffer. Intein autocleavage study allows removal of the ELP sequence at acidic pH, with the buffers MES and Tris-HCl The present study defined the best conditions for obtaining pure csACEN that the literature has not yet described for peptides. Obtaining pure csACEN aims at future studies for therapeutic use in hypertension, Alzheimer's, and oncology.
Palavras-Chave: angiotensin; enzymes; domain structure; polypeptides
. A new approach for purification of the catalytic site of the angiotensin-conversion enzyme, N-domain, mediated by the ELP-Intein system. Journal of Pharmacological and Toxicological Methods, v. 116, p. 1-6, 2022. DOI: 10.1016/j.vascn.2022.107174. Disponível em: http://repositorio.ipen.br/handle/123456789/33431. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Periplasmic synthesis and purification of the human prolactin antagonist Δ1‑11‑G129R‑hPRL. AMB Express, v. 11, n. 1, p. 1-12, 2021. DOI: 10.1186/s13568-021-01209-5 Abstract: The human prolactin antagonist Δ1-11-G129R-hPRL is a 21.9 kDa recombinant protein with 188 amino acids that downregulates the proliferation of a variety of cells expressing prolactin receptors. Periplasmic expression of recombinant proteins in E. coli has been considered an option for obtaining a soluble and correctly folded protein, as an alternative to cytoplasmic production. The aim of this work was, therefore, to synthesize for the first time, the Δ1-11-G129R-hPRL antagonist, testing different activation temperatures and purifying it by classical chromatographic techniques. E. coli BL21(DE3) strain was transformed with a plasmid based on the pET25b( +) vector, DsbA signal sequence and the antagonist cDNA sequence. Different doses of IPTG were added, activating under different temperatures, and extracting the periplasmic fluid via osmotic shock. The best conditions were achieved by activating at 35 °C for 5 h using 0.4 mM IPTG, which gave a specific expression of 0.157 ± 0.015 μg/mL/A600 at a final optical density of 3.43 ± 0.13 A600. Purification was carried out by nickel-affinity chromatography followed by size-exclusion chromatography, quantification being performed via high-performance size-exclusion chromatography (HPSEC). The prolactin antagonist was characterized by SDS-PAGE, Western blotting, reversed-phase high-performance liquid chromatography (RP-HPLC) and MALDI-TOF–MS. The final product presented > 95% purity and its antagonistic effects were evaluated in vitro in view of potential clinical applications, including inhibition of the proliferation of cancer cells overexpressing the prolactin receptor and specific antidiabetic properties, taking also advantage of the fact that this antagonist was obtained in a soluble and correctly folded form and without an initial methionine.
Palavras-Chave: lth; peptides; chromatography; neoplasms; purification; mass spectra; bioassay; plasma
. Periplasmic synthesis and purification of the human prolactin antagonist Δ1‑11‑G129R‑hPRL. AMB Express, v. 11, n. 1, p. 1-12, 2021. DOI: 10.1186/s13568-021-01209-5. Disponível em: http://repositorio.ipen.br/handle/123456789/31998. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Refolding of endostatin from inclusion bodies using high hydrostatic pressure. Analytical Biochemistry, v. 379, n. 1, p. 32-39, 2008.
Palavras-Chave: escherichia coli; proteins; hydrostatics; bacteria; inclusions; agglomeration; collagen; endothelium
. Refolding of endostatin from inclusion bodies using high hydrostatic pressure. Analytical Biochemistry, v. 379, n. 1, p. 32-39, 2008. Disponível em: http://repositorio.ipen.br/handle/123456789/4982. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. A simple strategy for the purification of native recombinant full-length human RPL10 protein from inclusion bodies. Protein Expression and Purification, v. 101, p. 115-120, 2014.
Palavras-Chave: ribosomes; messenger-rna; cloning; carcinomas; gene therapy; inclusions; folding model; tumor cells; inhibition; fluorescence spectroscopy
. A simple strategy for the purification of native recombinant full-length human RPL10 protein from inclusion bodies. Protein Expression and Purification, v. 101, p. 115-120, 2014. Disponível em: http://repositorio.ipen.br/handle/123456789/23190. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Spectroscopic and structural analysis of somatic and N-domain angiotensin I-converting enzyme isoforms from mesangial cells from Wistar and spontaneously hypertensive rats. International Journal of Biological Macromolecules, v. 47, n. 2, p. 238-243, 2010.
Palavras-Chave: angiotensin; enzyme inhibitors; antihypertensive agents; dichroism; spectroscopy; rats
. Spectroscopic and structural analysis of somatic and N-domain angiotensin I-converting enzyme isoforms from mesangial cells from Wistar and spontaneously hypertensive rats. International Journal of Biological Macromolecules, v. 47, n. 2, p. 238-243, 2010. Disponível em: http://repositorio.ipen.br/handle/123456789/8150. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Structural characterization and enzymatic activity of the recombinant Ala959 to Ser1066 region of human ace. Jacobs Journal of Enzymology and Enzyme Engineering, v. 3, n. 1, p. 1-13, 2017. Abstract: Angiotensin-converting enzyme catalyzes the conversion of angiotensin I to the vasoconstrictor angiotensin II and the hydrolysis of bradykinin (BK). Human somatic angiotensin-converting enzyme has two homologous domains (N and C) that share 60% identity. Although these two regions have high homology, the catalytic site of the C-domain exhibits three-fold greater activity than the N-domain in the hydrolysis of angiotensin I in vivo. The present study aimed to obtain the Ala959 to Ser1066 catalytic region of the C-domain of angiotensin-converting enzyme in a structural conformation that resembles its native form. We amplified the 324-bp sequence corresponding to the catalytic site of C-domain of angiotensin-converting enzyme and cloned this sequence into a pET28 vector. The catalytic site of C-domain of angiotensin-converting enzyme peptide was expressed in a bacterial system, and its purification was performed in one step using a His-tag affinity column. Structural analysis by circular dichroism and fluorescence confirmed that the purified protein is correctly folded, and catalytic site of C-domain of angiotensin-converting enzyme possesses enzymatic activity and is inhibited by lisinopril. This peptide can be used to test new inhibitors and C-domain of angiotensin-converting enzyme substrates because this peptide is easy to produce and this has proven efficient link with these molecules.
Palavras-Chave: enzyme activity; zinc; aluminium arsenides; recombination; proteins; catalysts
. Structural characterization and enzymatic activity of the recombinant Ala959 to Ser1066 region of human ace. Jacobs Journal of Enzymology and Enzyme Engineering, v. 3, n. 1, p. 1-13, 2017. Disponível em: http://repositorio.ipen.br/handle/123456789/28450. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-12 de 12
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

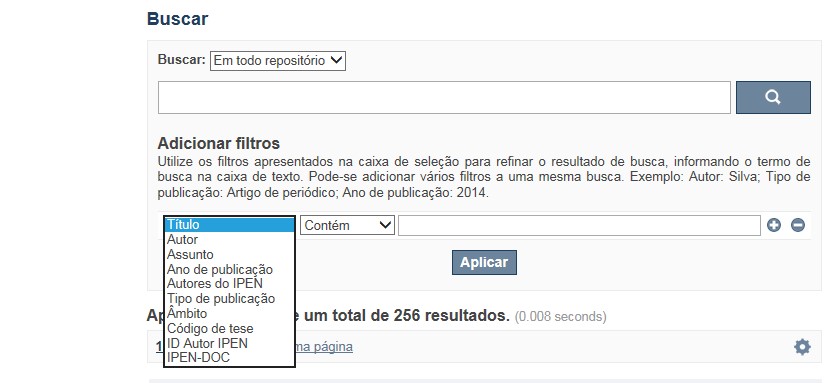
A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
