Navegação Teses por assunto "proteins"
- Página inicial
- →
- IPEN
- →
- Teses
- →
- Navegação Teses por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação Teses por assunto "proteins"
Itens para a visualização no momento 41-46 de 46
-
. Renaturacao em altas pressoes hidrostaticas de proteinas recombinantes agregadas em corpos de inclusao produzidos em Eschirichia coli / Refolding in high hydrostatic pressure of recombinant proteins from inclusion bodies in Escherichia Coli . 2009. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 68 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2009.tde-19112009-095254 Abstract: A expressão de proteínas na forma de corpos de inclusão em bactérias é uma alternativa muito interessante para obtenção de proteínas recombinantes. No entanto, a agregação é uma dificuldade frequentemente encontrada durante a renaturação dessas proteínas. Altas pressões hidrostáticas são capazes de solubilizar os corpos de inclusão na presença de baixas concentrações de reagentes desnaturantes, favorecendo a renaturação protéica com alto rendimento e redução de custos. O presente trabalho tem como objetivo a renaturação de proteínas recombinantes expressas em Escherichia coli sob a forma de corpos de inclusão usando altas pressões hidrostáticas. Três toxinas, todas apresentando cinco ou mais pontes dissulfídicas foram estudadas: NXH8, Naterina 2 e Bothropstoxina 1. Suspensões dos corpos de inclusão das três proteínas foram pressurizadas em 2000 bares de pressão durante 16 horas. Os tampões de renaturação foram otimizados para as três proteínas. O tampão utilizado no processo de renaturação da NXH8 foi Tris HCl 50 mM, pH 9,0 com proporção de 1GSH:4GSSG em concentração de 6 mM e 2 M GdnHCl. Foram utilizados corpos de inclusão em D.O.(A600nm) de 0,5. Após o processo de renaturação foi realizada diálise em pH 7,0. O rendimento final de recuperação de NXH8 solúvel foi de 40%, sendo obtidos 28,6 mg/L de meio de cultura. A renaturação de Bothropstoxina 1 foi obtida em tampão de renaturação Tris HCl 50 mM pH 7,5 na proporção de 2 GSH:3 GSSG em concentração de 3 mM e 1 M GdnHCl. Utilizamos uma suspensão com D.O.(A600nm) de 0,5. O rendimento final de recuperação de Bothropstoxina 1 renaturada foi de 32 %, obtendo-se 9,2 mg/L de meio de cultura. A renaturação de Naterina 2 foi obtida em tampão de renaturação com 20 mM de Tris HCl pH 9,0 na proporção de 2 GSH:3 GSSG e concentração de 10 mM e 1 M GdnHCl e corpos de inclusão na D.O. (A600nm) de 6,0. Foram obtidas 3,7 mg de Nateria 2 renaturada /L de meio de cultura (20% de recuperação a partir dos corpos de inclusão). O rendimento da Naterina 2 renaturada foi de 20 %. Para a análise e a comprovação da eficácia do processo de renaturação sob pressão foram utilizadas as técnicas de SDS-PAGE, western blot, microscopia eletrônica de varredura, ensaios biológicos in vivo e in vitro e estruturais. As análises físicoquímicas realizadas em NXH8 não mostraram nenhuma comprovação da sua renaturação. O ensaio in vivo realizado com a Naterina 2 mostrou uma leve atividade de contração de vênulas, indicando que ela esteja em sua conformação correta. Os ensaios in vitro com a Bothropstoxina 1 mostraram uma atividade citotóxica dose-dependente em células musculares.
Palavras-Chave: proteins; bacteria; escherichia coli; hydrostatics; pressurization; inclusions; agglomeration; spectroscopy
. Renaturacao em altas pressoes hidrostaticas de proteinas recombinantes agregadas em corpos de inclusao produzidos em Eschirichia coli. Orientador: Ligia Ely Morganti Ferreira Dias. 2009. 68 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2009.tde-19112009-095254. Disponível em: http://repositorio.ipen.br/handle/123456789/9457. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Renaturação da proteína de envelope do vírus da zika e do domínio III da mesma proteína utilizando altas pressões / Refolding of zika virus envelope protein and domain III of the same protein using high pressures . 2018. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 60 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2020.tde-03022020-094942 Abstract: Grande parte das proteínas de importância biomédica são encontradas em concentrações pequenas nas suas formas nativas. Uma alternativa para obtenção de proteínas em grande escala é síntese por bactérias Escherichia coli geneticamente modificadas. Entretanto, frequentemente essas proteínas são produzidas como agregados insolúveis e inativos, denominados de corpos de inclusão (CI). Para se tornarem bioativas as proteínas nos CI devem ser renaturadas. O nosso objetivo foi o estabelecimento de um processo rápido e eficiente de obtenção da proteína de envelope (E) e do domínio III desta mesma proteína (EDIII) do vírus da ZIKA (ZIKV) solúveis e com atividade imunológica a partir de CI. A utilização destas proteínas se justifica pela sua relevância para o desenvolvimento de ensaios diagnósticos e para a produção de vacinas de ZIKV. A associação de alta pressão e pH alcalino se mostrou eficiente para a solubilização dos CI. A incubação dos CI em alta pressão (2,4 kbar por 90 min e 0,4 kbar por 14,5 h) em pH de 10,5 foi a melhor condição encontrada na qual foi obtida solubilização eficiente dos CI com baixa desnaturação proteica. O enovelamento das proteínas presentes nos sobrenadantes das suspensões submetidas à alta pressão foi obtido por diálise em tampão em pH de 8,5. A recuperação do E solúvel nesta condição foi de mais de 90% e a de EDIII foi de 80% em relação às quantidades totais dessas proteínas nos CI e os rendimentos foram de 130 mg de E e de 35 mg de EDIII/L de cultura bacteriana. As proteínas E e EDIII permaneceram imunologicamente ativas e foram recuperadas principalmente como monômeros e dímeros. O procedimento proposto representa uma alternativa para a produção de proteínas recombinantes imunologicamente ativas expressas como CI.
Palavras-Chave: zika virus; molecular biology; elementary particles; proteins; bacterial spores; cell cultures; pressure range mega pa 10-100; immunotherapy; micellar systems; biotechnology
. Renaturação da proteína de envelope do vírus da zika e do domínio III da mesma proteína utilizando altas pressões. Orientador: Ligia Ely Morganti Ferreira Dias. 2018. 60 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2020.tde-03022020-094942. Disponível em: http://repositorio.ipen.br/handle/123456789/30804. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Renaturação sob alta pressão hidrostítica de tiorredoxinas de Xylella fastidiosa / Renaturation under high hidrostatic pressure of thioredoxins of Xylella fastidiosa . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 77 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2012.tde-06032013-132235 Abstract: Muitas das proteínas de valor biomédico relevante são encontradas em baixas concentrações em suas fontes nativas. O alto nível de expressão de proteínas recombinantes em E. coli, muitas vezes gera o acúmulo de proteínas como agregados insolúveis no citoplasma e/ou periplasma da bactéria, denominados de corpos de inclusão (CI). A alta pressão tem sido amplamente utilizada no estudo da conformação das proteínas,ela modula as interações proteína-proteína e proteína-solvente através de mudanças no volume das mesmas, promovendo a entrada de água nas cavidades não expostas da molécula e promovendo hidratação e solubilização dos agregados. O presente trabalho teve como objetivo a renaturação de proteínas recombinantes expressas como CI em Escherichia coli usando alta pressão hidrostática como condição branda de dissociação dos agregados. As tiorredoxinas TsnC e TrxA, a proteína YbbN e a proteína comigratória com bacterioferritina (Bcp), todas de Xylella fastidiosa, foram estudadas neste trabalho. As condições de renaturação foram otimizadas, utilizando-se diferentes proporções do par redox, concentrações de GdnHCl, presença de aditivos e esquemas de descompressão. Para a quantificação e análise da eficácia do processo de renaturação das proteínas sob pressão foram utilizadas as técnicas de microscopia eletrônica de varredura dos CI e de SDS-PAGE, e ensaios de atividade enzimática das proteínas. A TsnC foi renaturada em Tris HCl 50 mM com proporção de 10GSH:1GSSG em concentração final de 10 mM, 0,75 M GdnHCl, na presença de 0,5 M de Triton-X e a pressão utilizada foi de 2,4 kbar por 1 hora e 30 minutos seguida de descompressão direta e incubação por 16 horas em pressão atmosférica. O rendimento final de obtenção de TsnC solúvel foi altíssimo, de até 89,9%. A renaturação de proteína YbbN, nunca antes descrita, foi obtida em tampão de renaturação Tris HCl 50 mM, na presença de 0,5 M de L-Arginina e a pressão utilizada foi de 2,4 kbar por 1 hora e 30 minutos seguida de descompressão direta e incubação por 16 horas em pressão atmosférica. A proteína YbbN, que apresentou atividade de tioredoxina, foi renaturada com rendimento de até 98% a partir da proteína insolúvel nos CI. Foi possível a solubilização da tiorredoxina TrxA e Bcp sob alta pressão hidrostática em tampão de renaturação Tris HCl 50 mM, utilizando diferentes proporções do par redox na concentração final de 10 mM e 1,5 M de GdnHCl, porém não foi possível obter a atividade biológicas destas proteínas. Mostramos também que a L-Arginina apresenta efeito auxiliar na solubilização dos CI induzida pela alta pressão, e ao mesmo tempo se mostrou altamente protetora contra a inativação da atividade da YbbN promovida pela incubação em altas temperaturas, o que sugere que a presença deste aminoácido pode ter alta aplicabilidade juntamente com a aplicação de altas pressões para elevar os rendimentos de renaturação de proteínas recombinantes a partir de CI.
Palavras-Chave: proteins; bacterial diseases; microorganisms; hydrostatics; pressurization; scanning electron microscopy
. Renaturação sob alta pressão hidrostítica de tiorredoxinas de Xylella fastidiosa. Orientador: Ligia Ely Morganti Ferreira Dias. 2012. 77 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-06032013-132235. Disponível em: http://repositorio.ipen.br/handle/123456789/10165. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Secrecao de hormonio de crescimento de camundongo por queratinocitos humanos primarios: perspectivas para um modelo animal de terapia genica cutanea / Secretion of mouse growth hormone by transduced primary human keratinocytes: prospects for an animal model of cutaneous gene therapy . 2008. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 61 p. Orientador: Cibele Nunes Peroni. DOI: 10.11606/D.85.2008.tde-31082009-150915 Abstract: Queratinócitos são um veículo bastante atrativo para a transferência gênica ex vivo e liberação sistêmica uma vez que as proteínas secretadas por estas células podem atingir a circulação via um mecanismo similar ao processo natural. Um eficiente vetor retroviral (LXSN) contendo o gene do hormônio de crescimento de camundongo (mGH) foi utilizado para transduzir queratinócitos humanos primários. Os queratinócitos transduzidos apresentaram um nível de secreção in vitro alto e estável atingindo até 11 g mGH/106 células/dia. Os epitélios formados por estes queratinócitos geneticamente modificados apresentaram, porém, uma queda na taxa de secreção > 80 % quando foram retirados da placa de cultura utilizando um procedimento clássico. A substituição desta metodologia clássica por uma cultura organotípica resolveu completamente este problema. Camundongos anões imunodeficientes (lit/scid) implantados com estes enxertos organotípicos foram acompanhados durante 4 meses, e apresentaram um aumento de peso significativo (P<0,05) nos primeiros 40 dias. Níveis circulatórios de mGH atingiram um pico de 21 ng/mL 1 h após o implante, mas estes níveis rapidamente atingiram níveis basais (~2 ng/mL). Os queratinócitos humanos primários apresentaram portanto altos níveis de expressão in vitro e os maiores níveis circulatórios, porém por um breve período de tempo, reportados até o momento para GH neste tipo de células. Em conjunto com resultados que mostraram uma recuperação considerável da eficiência de secreção de mGH em cultura por enxertos organotípicos retirados dos animais, foram discutidos os fatores que ainda impedem a utilização clínica deste modelo promissor de terapia gênica cutânea.
Palavras-Chave: gene therapy; proteins; keratin; mice; animal growth; animal cells; sth; epidermis
. Secrecao de hormonio de crescimento de camundongo por queratinocitos humanos primarios: perspectivas para um modelo animal de terapia genica cutanea. Orientador: Cibele Nunes Peroni. 2008. 61 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2008.tde-31082009-150915. Disponível em: http://repositorio.ipen.br/handle/123456789/11725. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Toxinas do veneno de crotalus durissus terrificus. Interação proteína-proteína e cinética de troca isotópica hidrogênio-trício. 1978. Tese (Doutoramento) - Instituto de Quimica, Universidade de Sao Paulo - IQ/USP, Sao Paulo. 114 p. Orientador: Jose Moura Goncalves.
Palavras-Chave: hydrogen; interactions; isotopic exchange; proteins; snakes; toxins; tritium; venoms
. Toxinas do veneno de crotalus durissus terrificus. Interação proteína-proteína e cinética de troca isotópica hidrogênio-trício. Orientador: Jose Moura Goncalves. 1978. 114 f. Tese (Doutoramento) - Instituto de Quimica, Universidade de Sao Paulo - IQ/USP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/11329. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Utilização de altas pressões hidrostáticas para o estudo e renaturação de proteínas com estrutura quaternária / Utilization of high hydrostatic pressure for the study and refolding of proteins with quaternary structure . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 106 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2012.tde-06032013-144803 Abstract: A produção de proteínas recombinantes é uma ferramenta essencial para a indústria biotecnológica e suporta a expansão da pesquisa biológica moderna. Uma variedade de hospedeiros pode ser utilizada para produzir estas proteínas e dentre eles, as bactérias E. coli são as hospedeiras mais utilizadas. No entanto, a expressão heteróloga de genes em E. coli frequentemente resulta em um processo de enovelamento incompleto que leva ao acúmulo de agregados insolúveis, conhecidos como corpos de inclusão (CI). Altas pressões hidrostáticas são capazes de desfavorecer interações intermoleculares hidrofóbicas e eletrostáticas, levando à dissociação dos agregados e por isso são úteis para solubilizar e renaturar proteínas agregadas em CI. O presente trabalho teve como objetivo o estudo do processo de desagregação dos CI e de renaturação das proteínas oligoméricas subunidade B da toxina colérica (CTB) e região globular da fibra adenoviral (RGFA) utilizando altas pressões hidrostáticas. A toxina colérica (CT) é composta por uma subunidade A e cinco subunidades B combinadas em uma holotoxina AB5. A CTB é a porção pentamérica não tóxica da CT, responsável pela ligação da holotoxina ao receptor gangliosídeo GM1. A fibra do adenovírus é uma proteína homotrimérica que forma parte do capsídeo viral, organizada em três regiões: a cauda N-terminal, a haste central e a região C-terminal (região globular). A RGFA se liga à proteína de membrana CAR nas células hospedeiras e promove a internalização do vírus. Os estudos apresentados neste trabalho demonstraram que a alta pressão hidrostática foi eficaz na desagregação dos CI da CTB e da RGFA. As condições de renaturação foram otimizadas utilizando-se diferentes proporções do par redox glutationa oxidada e reduzida, concentrações de agentes caotrópicos, presença de aditivos e esquemas diferenciados de compressão/descompressão daqueles previamente descritos na literatura. CTB solúvel e pentamérica foi obtida pela compressão da suspensão de CI a 2,4 kbar por 16 horas em tampão TrisHCl 50 mM pH 8,5, 1 mM de tween 20 e descompressão direta seguida de incubação em pressão atmosférica. O rendimento de renaturação da CTB solúvel e pentamérica foi de até 45 % e 288 mg de CTB/litro de cultura bacteriana. Esta proteína apresentou estrutura regular e atividade biológica. RGFA trimérica foi obtida pela compressão da suspensão de CI em tampão TrisHCl 50 mM pH 8,0 e 0,5 M de L-arginina a 2,4 kbar por 1,5 horas e 0,4 kbar por 16 horas antes da completa descompressão. O rendimento de proteína solúvel trimérica da RGFA foi de 4 %, porém não foi possível obter a atividade biológica desta proteína.
Palavras-Chave: proteins; bacteria; escherichia coli; inclusions; hydrostatics; pressurization
. Utilização de altas pressões hidrostáticas para o estudo e renaturação de proteínas com estrutura quaternária. Orientador: Ligia Ely Morganti Ferreira Dias. 2012. 106 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-06032013-144803. Disponível em: http://repositorio.ipen.br/handle/123456789/10161. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 41-46 de 46
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
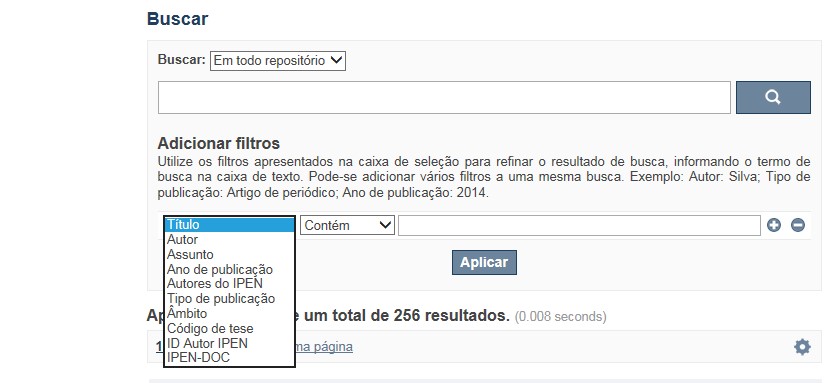
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
