Navegação Teses por assunto "escherichia coli"
- Página inicial
- →
- IPEN
- →
- Teses
- →
- Navegação Teses por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação Teses por assunto "escherichia coli"
Itens para a visualização no momento 1-20 de 20
-
. Clonagem de serino proteases do veneno da cascavel Crotalus durissus terrificus e expressão da giroxina em célula de mamífero. 2007. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 170 p. Orientador: Maria Aparecida Pires Camillo. DOI: 10.11606/D.85.2007.tde-16052012-081641 Abstract: As serino proteases participam de diversos processos fisiológicos (tal como o de coagulação) e patológicos. Essas enzimas estão amplamente distribuídas entre as espécies, são também toxinas dos venenos de serpentes, sendo denominadas SVSPs (snake venom serine proteases). Essas SVSPs são multifuncionais e contêm uma tríade catalítica formada pelos aminoácidos HDS. Algumas SVSPs são comercialmente disponíveis, sendo indicadas para o tratamento de infarto do miocárdio, tromboses e embolia pulmonar. No veneno de Crotalus durissus terrificus estão descritas até o momento, apenas duas SVSPs sendo que a mais estudada é a giroxina que representa cerca de 2,5% do veneno total. No presente estudo foi reportado a clonagem de sete serino proteases amplificadas a partir de uma biblioteca de cDNA de glândula de veneno de um único espécime adulto de Crotalus durissus terrificus. Estes clones foram analisados com relação à organização do cDNA, estrutura e prováveis funções. A construção do modelo tridimensional da giroxina permitiu verificar as similaridades com tripsina, trombina e outras SVSPs. A glicosilação e a presença de muitas pontes dissulfetos dificultam a obtenção das SVSP recombinantes na forma solúvel e com atividade, por expressão em E.coli. Assim, neste trabalho foi abordada a expressão em células de mamífero (que realiza as modificações pós-traducionais) com resultados promissores. Para tanto, o peptídeo sinal de Igk, a seqüência madura e a região 3 UTR da giroxina foram clonados no vetor pED, originando um novo vetor (pED-Giro). Este vetor carrega o peptídeo sinal de Igk, o que possibilitou a secreção da giroxina para o meio de cultura. O vetor pED-Giro foi transfectado em células CHO DXB11 dhfr e COS-7. A giroxina foi detectada no extrato total das células COS-7 por western blot e, em seguida, purificada do meio de cultura com coluna de afinidade (Benzamidina Sepharose) e demonstrado sua integridade pelo ensaio de atividade esterásica.
Palavras-Chave: snakes; venoms; enzymes; serine proteinases; cloning; trypsin; thrombin; escherichia coli; animal cells; mammary glands
. Clonagem de serino proteases do veneno da cascavel Crotalus durissus terrificus e expressão da giroxina em célula de mamífero. Orientador: Maria Aparecida Pires Camillo. 2007. 170 f. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2007.tde-16052012-081641. Disponível em: http://repositorio.ipen.br/handle/123456789/11593. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento de processo de fermentacao em biorreator para producao de prolactina humana secretada no espaco periplasmico de Escherichia coli / Development of the fermentation process in bioreactor for the production of human prolactin secreted in the periplasmic space of Escherichia coli . 2008. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 61 p. Orientador: Carlos Roberto Jorge Eduardo. DOI: 10.11606/D.85.2008.tde-07072009-152955 Abstract: A Prolactina (PRL) é um dos hormônios mais versáteis em termos de ação biológica. Sua ação mais conhecida está relacionada com o estímulo da lactação e regulação do crescimento e da diferenciação da glândula mamária; também apresenta importante aplicação diagnóstica. Somando os crescentes estudos sobre suas possíveis aplicações terapêuticas, fica cada vez mais notória a necessidade da obtenção desse hormônio puro, biologicamente ativo e na sua forma autêntica.O objetivo fundamental desse projeto foi a produção de hPRL em escala laboratorial a partir de bactérias (E.coli) modificadas geneticamente, utilizando um sistema de expressão baseado no promotor Lambda () PL, o mesmo utilizado com sucesso em nosso laboratório na expressão do hGH. Descrevemos nesse trabalho um processo de cultivo em biorreator, onde não foi utilizado o repressor cIts, uma proteína termo-sensível que usualmente é utilizada para inibir o funcionamento do promotor PL durante crescimento a 30ºC. O processo de cultivo apresenta basicamente três etapas: na primeira etapa o crescimento é realizado sem adição contínua de nutrientes (cultivo em batch), na segunda etapa ocorre adição contínua de nutrientes e carboidrato (cultivo em fed-batch) e na última etapa é realizada a ativação, caracterizada pelo aumento da temperatura mantendo-se a adição de nutrientes e carboidrato. Esse processo de fermentação rápido e flexível, com duração média de 20 horas, permitiu obter uma biomassa final correspondente à densidade óptica de aproximadamente 30 A600nm (unidades ópticas de absorbância em 600nm) e com uma expressão da ordem de 1g de hPRL mL-1 A600 -1, as mais altas já relatadas para secreção de prolactina no espaço periplásmico. A hPRL monomérica foi purificada e caracterizada por métodos físico-químicos e biológicos, os quais confirmaram a sua atividade biológica e imunológica, o seu correto processamento e uma massa molecular relativa (Mr) de 22.906.
Palavras-Chave: lth; escherichia coli; bioreactors; fermentation
. Desenvolvimento de processo de fermentacao em biorreator para producao de prolactina humana secretada no espaco periplasmico de Escherichia coli. Orientador: Carlos Roberto Jorge Eduardo. 2008. 61 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2008.tde-07072009-152955. Disponível em: http://repositorio.ipen.br/handle/123456789/11767. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento de processo de produção e caracterização de interferon-α2a secretado no espaço periplásmico de Escherichia Coli / Development of production process and characterization of periplasmic interferon-α2a expressed in Escherichia Coli . 2017. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 69 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2017.tde-04122017-150200 Abstract: Os IFN-α2 são atualmente utilizados em terapia de hepatite B e C, leucemia, mieloma múltiplo, leucemia de células pilosas, melanoma, sarcoma de Kaposi, linfoma folicular e carcinoma de células renais, em associação ou não com outras drogas. Este trabalho descreve um processo de produção, purificação e caracterização de interferon-α2a secretado para o espaço periplasmico de E. coli utilizando um vetor baseado no uso constitutivo do promotor lambda PL. Foi validada também uma análise em cromatografia líquida de alta eficiência em fase reversa (RP-HPLC) para monitoração do processo. Dessa forma, este trabalho descreve inicialmente um método de RP-HPLC para análise qualitativa e quantitativa de interferon-α2a e interferon-α2b. O método foi desenvolvido e validado quanto à recuperação, precisão, linearidade, sensibilidade e especificidade. O teste de recuperação indicou erro menor que 1 % e as determinações quantitativas intra-dia e inter-dia apresentaram desvio padrão relativo sempre menores que 4 %, enquanto a sensibilidade experimental foi de 0,3 μg (RSD = 5 %). Em relação à linearidade, o coeficiente de correlação assumiu o valor de 0,998 (p<0,0001), para o intervalo de massa analisada de 0,62 a 10 μg de interferon. Essa metodologia permite a aplicação de RP-HPLC como uma ferramenta poderosa para monitoração de níveis de expressão e qualidade do interferon-α2 durante ou logo após a fermentação. A temperatura ótima de expressão foi avaliada nos intervalos de 30 a 42 °C, em cultivo em erlenmeyer. As produções volumétrica e específica foram maiores para temperaturas iguais ou superiores a 35 °C. Dessa forma, considerando a potencial degradação da proteína recombinante induzida pela temperatura, a temperatura ótima para a expressão de interferon neste processo foi definida como 35 °C. Os maiores valores de produção específica e volumétrica obtidos, em produção em erlenmeyer, foram 1,04 μg/mL/A600 e 3,45 mg/L, respectivamente. Foi padronizado um método de purificação laboratorial, em duas etapas: uma cromatografia de troca iônica, seguida de uma etapa de cromatografia de exclusão molecular. A pureza final e a recuperação em massa foram de, respectivamente, 95,3 % e 66 %. O produto final também foi caracterizado por meio de análise em SDS-PAGE, western blotting, espectrometria de massas, HPLC de exclusão molecular e HPLC em fase reversa.
Palavras-Chave: interferon; proteins; bacteria; escherichia coli; recombinant dna; ion exchange chromatography; high-performance liquid chromatography; multiple production; mass spectroscopy; purification; site characterization
. Desenvolvimento de processo de produção e caracterização de interferon-α2a secretado no espaço periplásmico de Escherichia Coli. Orientador: Carlos Roberto Jorge Soares. 2017. 69 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2017.tde-04122017-150200. Disponível em: http://repositorio.ipen.br/handle/123456789/28422. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Efeitos nas caracteristicas fisico-quimicas, microbiologicas e sensoriais em amostras de mel de abelhas submetidas a radiacao gama / Effects on physicochemical, microbiological and sensory characteristics of honey bee samples submitted to gamma radiation . 2010. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 112 p. Orientador: Susy Frei Sabato. DOI: 10.11606/T.85.2010.tde-21062011-090149 Abstract: A produção de mel no Brasil tem aumentado consideravelmente e vem ganhando destaque no mercado internacional, consequentemente muitas exigências passaram a fazer parte da cadeia produtiva apícola. Além das análises previstas na legislação brasileira, o mercado externo procura produtos que atendam aos mais rigorosos padrões de qualidade. O mel possui características interessantes devido a sua constituição, porém, existem problemas que podem alterar seu padrão de identidade e qualidade. A aplicação da radiação gama é uma proposta viável que promove a diminuição da carga microbiana sem alterar a constituição e as características físico-químicas, com perdas nutricionais menores quando comparada a outros tratamentos usados em alimentos. Neste estudo, além dos parâmetros físico-químicos exigidos pela legislação brasileira (MAPA), também foram incluídas outras análises pertinentes, inclusive a técnica de espectroscopia no infravermelho com transformada de Fourier (FTIR-ATR). As análises microbiológicas foram realizadas nas amostras de méis puros, nas quais, posteriormente, foram inoculadas cargas microbianas conhecidas para avaliar a ação da radiação gama nas doses de 5 e 10 kGy. O teste triangular foi utilizado na análise sensorial para diferenciar as amostras não-irradiadas das irradiadas. As maiores modificações nas amostras de méis foram, principalmente, nas concentrações de HMF (hidroximetilfurfural) e na atividade diastásica, ocorrendo diminuição significativa em todas as amostras analisadas. Houve redução na carga microbiana a partir da aplicação da dose de 5 kGy, atingindo a ausência com a aplicação de 10 kGy de dose, com exceção do Paenibacillus larvae que mostrou ser mais resistente. A análise sensorial realizada nas amostras de mel e mel irradiado, com doses de 5, 10 e 15 kGy, apontou não haver diferença significativa (5%) entre as amostras controle e irradiadas. A aplicação da radiação gama em méis mostrou ser um método muito útil na descontaminação microbiológica, apresentando poucas alterações no produto com doses de até 10 kGy.
Palavras-Chave: bees; honey; sample preparation; gamma radiation; physical chemistry; chemical analysis; quality control; fourier transform spectrometers; aspergillus; bacillus; clostridium; cobalt 60; escherichia coli; experimental data; fourier transformation; infrared spectra; radiation doses
. Efeitos nas caracteristicas fisico-quimicas, microbiologicas e sensoriais em amostras de mel de abelhas submetidas a radiacao gama. Orientador: Susy Frei Sabato. 2010. 112 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/T.85.2010.tde-21062011-090149. Disponível em: http://repositorio.ipen.br/handle/123456789/9527. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Ensaio imunorradiometrico para a determinacao de proteinas bacterianas contaminantes em lotes de hormomio de crescimento humano recombinante produzido no IPEN-CNEN/SP. 1995. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 83 p. Orientador: Paolo Bartolini.
Palavras-Chave: escherichia coli; experimental data; immune serums; iodine 125; labelling; purification; rabbits; radioimmunoassay; recombinant dna; sth
. Ensaio imunorradiometrico para a determinacao de proteinas bacterianas contaminantes em lotes de hormomio de crescimento humano recombinante produzido no IPEN-CNEN/SP. Orientador: Paolo Bartolini. 1995. 83 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/9259. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo da acao da radiacao gama de sup(60)Co sobre Salmonella poona, Escherichia coli e Alicyclobacillus Acidoterrestris em polpa de manga congelada / Study of the action of 60Co gamma radiation on Salmonella poona, Escherichia coli and Alicyclobacillus acidoterrestris in mango pulp . 2009. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 93 p. Orientador: Nelida Lucia Del Mastro. DOI: 10.11606/T.85.2009.tde-27102009-100426 Abstract: A aplicação de tratamentos não-térmicos têm se mostrado eficiente na inibição de bactérias como Salmonella spp e Escherichia coli. A manga é uma fruta de consumo nacional que possui grande potencial de exportação. Entretanto, surtos de doenças transmitidas por alimentos relacionados a essa fruta provocaram desconfiança sobre o grau de segurança alimentar oferecido pelo produto. O objetivo deste trabalho foi determinar a radiorresistência das bactérias Escherichia coli, Salmonella poona e Alicyclobacillus acidoterrestris na polpa de manga através do cálculo do valor D10 e conhecer o efeito da radiação gama sobre as características organolépticas de polpa de manga. Foi também estabelecido o perfil microbiológico de polpas de manga congeladas disponíveis no mercado utilizando métodos convencionais de plaqueamento e Número Mais Provável (NMP). As polpas contaminadas experimentalmente com as bactérias citadas acima foram irradiadas com doses de 0, 1, 2, 3, 4 e 5 kGy, em fonte de 60Co. A análise sensorial foi feita utilizando dose de 5 kGy, aplicando o teste triangular e o teste de aceitação com escala hedônica. Os resultados deste trabalho mostram que a qualidade das polpas de manga comercializadas não é satisfatória de acordo com os padrões estabelecidos pela lei brasileira e pela literatura, mostrando a necessidade da implantação de outras ferramentas para se alcançar níveis de qualidade aceitáveis. Os valores de D10 obtidos se situaram entre 1,01 e 1,09kGy para E. coli ATCC 8739, entre 0,6 e 0,98kGy para S. poona e entre 0,72 e 0,88kGy para A. acidoterrestris respectivamente. A análise sensorial mostrou que a dose de 5kGy alterou as características sensoriais da polpa de manga. Entretanto, quando a polpa irradiada foi utilizada como ingrediente, o produto obteve boa aceitação nos atributos de aparência geral, sabor e aroma.
Palavras-Chave: food processing; fruits; mangoes; market; brazil; gamma radiation; cobalt 60; radiation doses; radiation effects; radiosensitivity; sensors; salmonella; escherichia coli; bacteria; food industry
. Estudo da acao da radiacao gama de sup(60)Co sobre Salmonella poona, Escherichia coli e Alicyclobacillus Acidoterrestris em polpa de manga congelada. Orientador: Nelida Lucia Del Mastro. 2009. 93 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/T.85.2009.tde-27102009-100426. Disponível em: http://repositorio.ipen.br/handle/123456789/9425. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo da dinâmica de fotodegradação e agregação das fenotiazinas azul de metileno e azul de orto-toluidina com relação a eficiência fotodinâmica. 2007. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. p. Orientador: Martha Simoes Ribeiro. DOI: 10.11606/T.85.2007.tde-29112007-172514 Abstract: A terapia fotodinâmica apresenta-se como uma possível alternativa terapêutica para o tratamento de infecções localizadas, porém, para sua aplicação clínica, as variáveis relacionadas à eficiência fotodinâmica devem ser analisadas para a obtenção de resultados satisfatórios. Os objetivos deste trabalho foram investigar a dinâmica de agregação dos fotossensibilizadores azul de metileno e azul de orto-toluidina em diferentes solventes, caracterizar os solventes em relação ao oxigênio molecular disponível em cada solução e seu respectivo pH, observar o efeito da temperatura, sangue e saliva na agregação dos fotossensibilizadores, monitorar a dinâmica de fotodegradação em função da exposição radiante e irradiância, avaliar a eficiência fotodinâmica microbiologicamente e através da produção de 1O2. Os solventes utilizados foram água deionizada, água destilada, água estéril, solução salina 0,9% e solução salina 0,45%. Em cada uma das soluções, foi realizado teste de pH e medição de oxigênio dissolvido por sonda apropriada. Os efeitos de fluidos, temperatura e concentração na agregação dos fotossensibilizadores foram analisados através de espectroscopia de absorção óptica. A dinâmica de fotodegradação foi testada com diferentes exposições radiantes e irradiâncias, nos comprimentos de onda adequados para cada composto. As irradiações foram realizadas com emissão de banda larga e banda estreita. A eficiência fotodinâmica foi avaliada através da medição direta da luminescência do oxigênio singleto em ?=1270nm, em dois solventes. Testes microbiológicos foram realizados com culturas de Escherichia coli. Os resultados obtidos demonstram que a dinâmica de agregação está diretamente relacionada com solvente e concentração: a solução salina apresentou diferença em relação aos demais solventes em todos os quesitos analisados. Dos solventes testados, a água deionizada apresentou os melhores resultados. A dinâmica de fotodegradação está relacionada, em sua magnitude, com a exposição radiante e, em sua dinâmica, com a irradiância. O uso de banda larga para irradiação foi mais efetivo para na fotossensibilização letal. Portanto, para a aplicação clínica da terapia, o substrato deve ser considerado. Apropriadas condições de irradiação, solvente e concentração de fotossensibilizador aumentam a eficiência do processo.
Palavras-Chave: therapy; methylene blue; toluidine blue; solvents; photosensitivity; absorption spectra; spectroscopy; phenothiazines; escherichia coli; lasers
. Estudo da dinâmica de fotodegradação e agregação das fenotiazinas azul de metileno e azul de orto-toluidina com relação a eficiência fotodinâmica. Orientador: Martha Simoes Ribeiro. 2007. f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2007.tde-29112007-172514. Disponível em: http://repositorio.ipen.br/handle/123456789/11562. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo da expressao citoplasmica bacteriana de uma forma de prolactina humana e de sua solubilizacao e renaturacao a partir de corpos de inclusao. 2000. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 105 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; escherichia coli; cytoplasm; bacteriophages; recombinant dna; separation processes; solubility; purification; hormones; genes; bacteria
. Estudo da expressao citoplasmica bacteriana de uma forma de prolactina humana e de sua solubilizacao e renaturacao a partir de corpos de inclusao. Orientador: Paolo Bartolini. 2000. 105 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10835. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo dos perfis de N-glicosilação da prolactina recombinante humana expressa em células humanas HEK293 / Study of N-glycosylate profiles of human recombinant prolactin expressed in human cells HEK293 . 2018. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 75 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2018.tde-28092018-142442 Abstract: A prolactina humana (hPRL) é um hormônio sintetizado pela hipófise com inúmeras funções tais como: lactação, reprodução e regulação osmótica. Este hormônio é frequentemente dosado em casos de problemas na lactação, infertilidade, além de estudos que elucidam sua ligação em alguns tipos de câncer (mama, próstata e útero). A hPRL é encontrada na forma não glicosilada (NG-hPRL) (23 kDa) e glicosilada (G-hPRL) (25 kDa), sendo a isoforma glicosilada um modelo ideal de análise de perfil de N-glicanos, já que possui um único sítio de glicosilação localizado na Asparagina 31. A glicosilação está relacionada diretamente à solubilidade, à estabilidade, ao enovelamento, à meia-vida e atividade biológica in vivo. As células de ovário de hamster chinês (CHO) e as células embrionárias de rim humano (HEK293) são os hospedeiros mais utilizados para expressão de proteínas recombinantes, já que podem ser cultivadas em altas densidades e por possuírem similaridade nas modificações pós-traducionais. O objetivo foi expressar, purificar e realizar uma caracterização físico-química e biológica da hPRL glicosilada de células HEK293, incluindo análise da estrutura de carboidratos. Para tanto, foi realizada uma transfecção em células HEK293T (aderidas) com o vetor pcDNA 3.4-TOPO. Foi obtida uma expressão de 21,26 ± 8,3 μg/mL de hPRL no meio condicionado sem soro. A hPRL foi purificada por cromatografia de afinidade a metais imobilizados (IMAC), eluindo 92% da hPRL em uma única fração que, analisada por HPSEC, apresentou pureza de 97%. O perfil de N-glicanos da amostra apresentou seis espécies, todas com terminação em ácido-siálico, do tipo complexo, sendo bi, tri e tetra-antenárias, com relativa predominância da espécie N2G2S1 (29,4%). A bioatividade in vitro da G-hPRL HEK293 demonstrou ser ≅ 16 vezes menor que a G-hPRL produzida em células CHO.
Palavras-Chave: embryonic cells; animal cells; kidneys; escherichia coli; glycosyl transferases; lth; gonadotropins; high-performance liquid chromatography
. Estudo dos perfis de N-glicosilação da prolactina recombinante humana expressa em células humanas HEK293. Orientador: Carlos Roberto Jorge Soares. 2018. 75 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2018.tde-28092018-142442. Disponível em: http://repositorio.ipen.br/handle/123456789/29634. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudos de renaturação de proteínas agregadas utilizando altas pressões hidrostáticas / Renaturation studies of aggregate proteins using high hydrostatic pressure . 2013. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 87 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/T.85.2013.tde-31052013-100320 Abstract: No presente trabalho estudamos a renaturação sob alta pressão hidrostática de uma forma mutante da proteína verde fluorescente (enhanced GFP, eGFP), a qual somente emite fluorescência característica quando enovelada na sua forma nativa. A abordagem do presente estudo foi focada no controle da bioatividade da proteína recombinante, a fluorescência, como alternativa à determinação de solubilidade da proteína, fator que não é um indicador ideal de enovelamento proteico adequado. A ação da alta pressão na solubilização dos corpos de inclusão (CI) de eGFP produzidos em bactérias E. coli recombinantes e no enovelamento da proteína foi estudada. A compressão dos CI de eGFP em 2,4 kbar durante 30 minutos promoveu a dissociação dos agregados. No entanto, a incubação nesta condição não favoreceu o enovelamento da eGFP. O processo de renaturação foi avaliado em diversas condições de descompressão após a dissociação em 2,4 kbar. Durante a descompressão gradual, o aumento da fluorescência foi obtido em pressões que variaram entre a pressão atmosférica e 1,38kbar. Os níveis mais elevados de fluorescência de eGFP foram obtidos por incubação durante várias horas a níveis de pressão entre 0,35 e 0,69 kbar. Esta condição de pressão se mostrou favorável à renaturação de eGFP e é possível que também possa ser utilizada para favorecer o enovelamento de outras proteínas monoméricas. Ainda utilizando a eGFP como modelo, verificamos que os CI desta proteína produzidos por bactérias cultivadas em menor temperatura (37ºC) possuem maior quantidade de proteína recombinante apresentando a fluorescência característica em 509 nm, ou seja, na sua forma nativa, do que os CI expressos em temperaturas mais elevadas (42ºC e 47ºC). A análise realizada por espectroscopia de infravermelho (FT-IR) também demonstrou que os CI produzidos em temperaturas mais brandas possuem maior grau de estruturas secundárias semelhantes às da proteína na sua forma nativa. Além disso, os CI produzidos a 37ºC também são mais facilmente solubilizados pela ação da alta pressão do que aqueles produzidos em maior temperatura. Conforme esperado, a renaturação da eGFP a partir de CI produzidos a 37ºC foi 25 vezes mais eficiente do que a obtida utilizando CI produzidos a 47ºC. No presente estudo demonstramos também que a dissociação dos agregados exercida pela ação da alta pressão (2,4 kbar) pode ser amplificada quando em associação com a incubação em baixa temperatura (-9ºC) e que a combinação destas duas propriedades físicas eleva a solubilização dos agregados em CI, com a consequente elevação dos rendimentos de renaturação de eGFP. Mostramos ainda no presente estudo que a cinética de renaturação de eGFP em 0,69 kbar é proporcional à temperatura de incubação (entre 10ºC e 50ºC). O nível mais elevado de fluorescência foi obtido quando a renaturação de eEGP foi realizada a 20ºC. A taxa de maturação do cromóforo da eGFP é mais fortemente afetada pela temperatura do que a taxa de enovelamento da proteína. Em conclusão, a temperatura de produção dos CI, a temperatura de dissociação dos agregados e a temperatura de enovelamento podem afetar muito o rendimento e a cinética da renaturação de eGFP em alta pressão. Os resultados do presente estudo podem abrir novas perspectivas para melhorias no processo de enovelamento de proteínas a partir de CI utilizando alta pressão. Também neste trabalho descrevemos a renaturação das proteínas de Xac, PilB e os produtos dos genes XAC2810 e XAC3272 nunca antes obtidas na forma solúvel. Os rendimentos de solubilização destas três proteínas foram muito altos, entre 75% e 89%. A proteína PilB renaturada em alta pressão apresentou atividade ATPasica elevada, o que nunca antes foi demonstrado para a PilB de Xac.
Palavras-Chave: proteins; protein denaturation; gene recombination; pressure dependence; fluorescence; activity levels; control; escherichia coli; fourier transformation; infrared spectra; scanning electron microscopy
. Estudos de renaturação de proteínas agregadas utilizando altas pressões hidrostáticas. Orientador: Ligia Ely Morganti Ferreira Dias. 2013. 87 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2013.tde-31052013-100320. Disponível em: http://repositorio.ipen.br/handle/123456789/10205. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Expressão, purificação e caracterização físico-química da rhBMP-2 (recombinante humana BMP-2) / Expression, purification and physical-chemical characterization of rhBMP-2 . 2019. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 85 p. Orientador: Daniel Perez Vieira. DOI: 10.11606/D.85.2019.tde-17102019-105240 Abstract: As proteínas morfogenéticas ósseas (BMPs) são um grupo proteico pertencente à superfamília dos fatores transformadores de crescimento beta (TGF-β). Dentre estas, a BMP-2 humana recombinante (rhBMP-2) tem sido amplamente estudada, devido suas propriedades osteoindutoras. Já existe a comercialização desta proteína produzida por tecnologia de DNA recombinante em células de ovário de hamster chinês (CHO) e para fins de pesquisa, a expressa no citoplasma de bactérias Escherichia coli (E. coli). A rhBMP-2 na sua forma homodimérica possui alta atividade biológica, induzindo a mineralização óssea em ossos endocondrais e a diferenciação de células mesenquimais em osteoblastos e osteoclastos. O objetivo desse trabalho consistiu em obter a rhBMP-2 através da produção em bactérias E. coli, altamente purificada através de técnicas cromatográficas e com atividade biológica. As cepas utilizadas para produção foram a W3110 e a BL21(DE), transformadas com plasmídeos contendo o cDNA da hBMP-2 cultivadas em três temperaturas de expressão: 25 °C, 37 °C e 42 °C. Para purificação dessa proteína foram utilizadas duas técnicas cromatográficas: afinidade a heparina e exclusão molecular por cromatografia líquida de alto desempenho (HPSEC). As coletas destas etapas de purificação levaram a separação de oito produtos que foram caracterizados por eletroforese em gel de poliacrilamida (SDS-PAGE) e Western Blotting (WB). A atividade biológica foi averiguada por produção de fosfatase alcalina em células mioblásticas de camundongo (C2C12). A avaliação dos produtos comerciais também foi feita através dessas técnicas. Os resultados indicaram que dois dos oito produtos purificados, um obtido a partir da produção na cepa BL21(DE) à 25 °C e outro da produção na cepa W3110 à 42 °C, apresentaram relevante grau de pureza e atividade biológica.
Palavras-Chave: biochemistry; protein engineering; interaction cells; skeleton; molecular biology; escherichia coli; bacteria; high-performance liquid chromatography; physical chemistry; testing; performance
. Expressão, purificação e caracterização físico-química da rhBMP-2 (recombinante humana BMP-2). Orientador: Daniel Perez Vieira. 2019. 85 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2019.tde-17102019-105240. Disponível em: http://repositorio.ipen.br/handle/123456789/30313. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Influência da temperatura de cultivo na expressão de proteínas recombinantes de interesse terapêutico no espaço periplásmico bacteriano, utilizando o promotor lambda PL / Influence of the cultivation temperature on the expression of recombinant proteins of therapeutic interest in the periplasmic space, using lambda PL promoter . 2015. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 87 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/T.85.2015.tde-19102015-150711 Abstract: O sistema de expressão baseado nos promotores PL ou PR do fago lambda que usualmente é regulado pelo repressor termo lábil (cIts) é amplamente utilizado para produzir proteínas recombinantes em células procarióticas. No entanto, o aumento da temperatura requerido neste sistema para promover a inativação do repressor apresenta algumas limitações, como o aumento da expressão de proteínas de HSP (Heat Shock Proteins), por exemplo, proteases, que dependendo da natureza da proteína expressa podem ser prejudiciais ou não. Uma outra limitação é a ativação da resposta SOS, resultando na parada da replicação do DNA celular ou dependendo da cepa pode ocorrer lise celular. Nesse trabalho nós descrevemos o uso do promotor λPL para expressão constitutiva, isto é, sem a regulação do repressor. Nós otimizamos diferentes condições de cultura para aumentar a secreção no espaço periplásmico de Escherichia coli de cinco proteínas: o hormônio do crescimento humano (hGH), que tem sido amplamente utilizado no tratamento de crianças com deficiência e/ou resistência ao hGH, síndrome de Turner, entre outras desordens; prolactina humana (hPRL), um hormônio polipeptídico conhecido por estimular a lactação e por exercer ação regulatória no crescimento e na diferenciação da glândula mamária, dois antagonistas de hPRL, estudados como potenciais fármacos para o tratamento de alguns tipos de cânceres e por fim o interferon α2a (IFN-α2a), que é uma citocina produzida pelas células, em resposta a diferentes estímulos, incluindo ácidos nucléicos virais, células estranhas (particularmente as neoplásicas), antígenos de bactérias, protozoários e vírus. No caso do IFN-α2a, essa citocina de alto valor agregado e de importante aplicação terapêutica, foi desenvolvida em nosso laboratório como parte desse trabalho, incluindo o desenvolvimento e a validação da metodologia de análise por HPLC de fase reversa para determinação do IFN presente no fluído periplásmico bacteriano ou na sua forma pura. As principais estratégias utilizadas para melhorar a expressão foram iniciar a indução junto à densidade óptica máxima do crescimento bacteriano e otimizar a temperatura de indução para controlar a expressão da proteína heteróloga. Essa metodologia pode ser utilizada nos casos onde o produto não será tóxico para a célula hospedeira ou quando a instabilidade do plasmídeo não é problema. A possibilidade de cultivo em temperaturas mais baixas, já que o repressor termo-sensível não se encontra presente, colaborou para o aumento significativo da expressão, mesmo para proteínas menos sensíveis à temperatura de cultivo, como o hGH.
Palavras-Chave: recombinant dna; proteins; escherichia coli; sth; lth; peptide hormones; plasmids; chromatography
. Influência da temperatura de cultivo na expressão de proteínas recombinantes de interesse terapêutico no espaço periplásmico bacteriano, utilizando o promotor lambda PL. Orientador: Carlos Roberto Jorge Soares. 2015. 87 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2015.tde-19102015-150711. Disponível em: http://repositorio.ipen.br/handle/123456789/25195. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Obtenção, caracterizações estruturais e atividade enzimática do sítio C-catalítico da enzima conversora de angiotensina I - região ALAsup(959) até SERsup(1066) / Obtaining, structural characterization and enzymatic activity of the C catalytic site of angiotensin convertin enzyme I ALA959 to SER1066 region . 2015. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 63 p. Orientador: Regina Affonso. DOI: 10.11606/D.85.2015.tde-23112015-083845 Abstract: A enzima conversora de angiotensina (ECA) catalisa a conversão de angiotensina I (Ang I) no vasoconstritor angiotensina II (Ang II) e hidrolisa a bradicinina (BK). ECA somática (sECA) possui dois domínios homólogos (N e C) que têm 60% de identidade. Embora estas duas regiões tenham homologia grande, o sítio catalítico C-domínio exibe uma atividade três vezes maior do que o N-domínio na hidrolise de Ang I in vivo. Este fato torna interessante o desenvolvimento de novos estudos de inibidores ou a melhoria dos já existentes. O objetivo deste estudo foi obter a região Ala959 até Ser1066 do Cdomínio da sECA (c-sECA), em uma estrutura conformacional semelhante à estrutura nativa. Nós amplificamos a sequência correspondente ao sítio catalítico da c-sECA com 324pb e clonamos esta sequência no vetor pET 28a(+). O segmento (nomeado de pET28_c-sECA) foi expresso em sistema bacteriano. A proteína foi expressa na forma solúvel e a purificação foi feita em uma única etapa utilizando a coluna de afinidade His-tag, a qual produziu a proteína pura. Análises estruturais por dicroísmo circular e fluorescência confirmaram que a proteína recombinante estava na conformação correta, e os ensaios de atividade mostraram que a c-sECA possui atividade enzimática e é inibida por lisinopril.
Palavras-Chave: cardiovascular diseases; cardiovascular system; blood circulation; hypertension; enzyme inhibitors; enzyme activity; angiotensin; dna; escherichia coli; protein structure; molecular biology
. Obtenção, caracterizações estruturais e atividade enzimática do sítio C-catalítico da enzima conversora de angiotensina I - região ALAsup(959) até SERsup(1066). Orientador: Regina Affonso. 2015. 63 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2015.tde-23112015-083845. Disponível em: http://repositorio.ipen.br/handle/123456789/25320. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Otimizacao da expressao periplasmica do gene do hGH em Escherichia coli utilizando o promotor lambidaPsub(L). 2004. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 63 p. Orientador: Carlos Roberto Jorge Soares.
Palavras-Chave: sth; recombinant dna; escherichia coli; cell cultures; gene amplification; molecular biology
. Otimizacao da expressao periplasmica do gene do hGH em Escherichia coli utilizando o promotor lambidaPsub(L). Orientador: Carlos Roberto Jorge Soares. 2004. 63 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/11181. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Padronizacao de um metodo de HPLC em fase reversa para determinacao de prolactina em extratos bacteriano e em sua forma purificada: sua aplicacao em estudo colaborativo internacional promovido pela O.M.S. 2002. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 58 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; purification; escherichia coli; high-performance liquid chromatography; accuracy
. Padronizacao de um metodo de HPLC em fase reversa para determinacao de prolactina em extratos bacteriano e em sua forma purificada: sua aplicacao em estudo colaborativo internacional promovido pela O.M.S. Orientador: Paolo Bartolini. 2002. 58 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/11076. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Producao de prolactina humana autentica por tecnicas de DNA recombinante. 1993. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 90 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; production; recombinant dna; radioimmunoassay; hormones; escherichia coli; diagnostic techniques; sth; proteins; plasmids
. Producao de prolactina humana autentica por tecnicas de DNA recombinante. Orientador: Paolo Bartolini. 1993. 90 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10351. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Purificacao de hormonio de crescimento humano recombinante obtido no espaco periplasmico de ESCHERICHIA COLI, visando sua aplicacao clinica. 1999. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 69 p. Orientador: Maria Teresa de Carvalho Pinto Ribela.
Palavras-Chave: sth; purification; yields; escherichia coli; precipitation; ion exchange chromatography; liquid column chromatography; radioimmunoassay; accuracy; proteins
. Purificacao de hormonio de crescimento humano recombinante obtido no espaco periplasmico de ESCHERICHIA COLI, visando sua aplicacao clinica. Orientador: Maria Teresa de Carvalho Pinto Ribela. 1999. 69 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10755. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Renaturacao em altas pressoes hidrostaticas de proteinas recombinantes agregadas em corpos de inclusao produzidos em Eschirichia coli / Refolding in high hydrostatic pressure of recombinant proteins from inclusion bodies in Escherichia Coli . 2009. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 68 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2009.tde-19112009-095254 Abstract: A expressão de proteínas na forma de corpos de inclusão em bactérias é uma alternativa muito interessante para obtenção de proteínas recombinantes. No entanto, a agregação é uma dificuldade frequentemente encontrada durante a renaturação dessas proteínas. Altas pressões hidrostáticas são capazes de solubilizar os corpos de inclusão na presença de baixas concentrações de reagentes desnaturantes, favorecendo a renaturação protéica com alto rendimento e redução de custos. O presente trabalho tem como objetivo a renaturação de proteínas recombinantes expressas em Escherichia coli sob a forma de corpos de inclusão usando altas pressões hidrostáticas. Três toxinas, todas apresentando cinco ou mais pontes dissulfídicas foram estudadas: NXH8, Naterina 2 e Bothropstoxina 1. Suspensões dos corpos de inclusão das três proteínas foram pressurizadas em 2000 bares de pressão durante 16 horas. Os tampões de renaturação foram otimizados para as três proteínas. O tampão utilizado no processo de renaturação da NXH8 foi Tris HCl 50 mM, pH 9,0 com proporção de 1GSH:4GSSG em concentração de 6 mM e 2 M GdnHCl. Foram utilizados corpos de inclusão em D.O.(A600nm) de 0,5. Após o processo de renaturação foi realizada diálise em pH 7,0. O rendimento final de recuperação de NXH8 solúvel foi de 40%, sendo obtidos 28,6 mg/L de meio de cultura. A renaturação de Bothropstoxina 1 foi obtida em tampão de renaturação Tris HCl 50 mM pH 7,5 na proporção de 2 GSH:3 GSSG em concentração de 3 mM e 1 M GdnHCl. Utilizamos uma suspensão com D.O.(A600nm) de 0,5. O rendimento final de recuperação de Bothropstoxina 1 renaturada foi de 32 %, obtendo-se 9,2 mg/L de meio de cultura. A renaturação de Naterina 2 foi obtida em tampão de renaturação com 20 mM de Tris HCl pH 9,0 na proporção de 2 GSH:3 GSSG e concentração de 10 mM e 1 M GdnHCl e corpos de inclusão na D.O. (A600nm) de 6,0. Foram obtidas 3,7 mg de Nateria 2 renaturada /L de meio de cultura (20% de recuperação a partir dos corpos de inclusão). O rendimento da Naterina 2 renaturada foi de 20 %. Para a análise e a comprovação da eficácia do processo de renaturação sob pressão foram utilizadas as técnicas de SDS-PAGE, western blot, microscopia eletrônica de varredura, ensaios biológicos in vivo e in vitro e estruturais. As análises físicoquímicas realizadas em NXH8 não mostraram nenhuma comprovação da sua renaturação. O ensaio in vivo realizado com a Naterina 2 mostrou uma leve atividade de contração de vênulas, indicando que ela esteja em sua conformação correta. Os ensaios in vitro com a Bothropstoxina 1 mostraram uma atividade citotóxica dose-dependente em células musculares.
Palavras-Chave: proteins; bacteria; escherichia coli; hydrostatics; pressurization; inclusions; agglomeration; spectroscopy
. Renaturacao em altas pressoes hidrostaticas de proteinas recombinantes agregadas em corpos de inclusao produzidos em Eschirichia coli. Orientador: Ligia Ely Morganti Ferreira Dias. 2009. 68 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2009.tde-19112009-095254. Disponível em: http://repositorio.ipen.br/handle/123456789/9457. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Renaturação das proteínas não estruturais 1(NS1) dos vírus da zika e da dengue utilizando altas pressões / Refolding of non-structural proteins 1 (NS1) of zika and dengue viruses using high . 2017. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 78 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2018.tde-26102017-123523 Abstract: As principais matérias primas necessárias para a preparação de testes diagnósticos são as proteínas dos patógenos que necessariamente apresentem as estruturas nativas. O objetivo do presente estudo foi a obtenção das proteínas não estruturais 1 (NS1) dos vírus da dengue (DENV) e da zika (ZIKV) a partir dos corpúsculos de inclusão (CI) produzidos em bactérias Escherichia coli. Mostramos que a combinação de alta pressão hidrostática (APH) e pH alcalino é eficiente para a solubilização de NS1-CI. A incubação em 2,4 kbar das suspensões de NS1-CI em pH alcalino mostrou-se eficiente para a solubilização da NS1. A presença de Arg promove a dissociação de oligômeros. A aplicação de 2,4 kbar às suspensões de NS1-CI em pH de 10,5 (DENV) e de 11,5 (ZIKV) na presença de Arg e um par redox, seguida de diálise em tampão em pH 8,5, foram as condições escolhidas para o reenovelamento de NS1. Obtivemos ambas NS1 com rendimentos entre 75% e 90% em relação às quantidades totais das proteínas presente nos correspondentes CI de NS1. As NS1 reenoveladas apresentaram reatividade comparável às proteínas obtidas utilizando um protocolo convencional estabelecido, com rendimentos mais de 25 vezes superiores. Foi obtido um processo altamente eficiente para o reenovelamento de NS1 apresentando características biológicas preservadas em relação a reatividade com anticorpos específicos de antígeno, incluindo soro de paciente infectado com zikv e que, portanto, podem ser usados como antígeno para o desenvolvimento de vacinas ou testes de diagnóstico. Além disso, este estudo descreve a criação de um processo inovador, que é a utilização concomitante de APH e pH alcalino, para solubilização e posterior reenovelamento de NS1-CI que podem ser utilizados para outras proteínas relevantes.
Palavras-Chave: microorganisms; bacteria; escherichia coli; viral diseases; microstructure; folding model; pore pressure; hydrostatics; stability; antibody formation; alkaline hydrolysis; fluorescence spectroscopy; enzyme immunoassay
. Renaturação das proteínas não estruturais 1(NS1) dos vírus da zika e da dengue utilizando altas pressões. Orientador: Ligia Ely Morganti Ferreira Dias. 2017. 78 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2018.tde-26102017-123523. Disponível em: http://repositorio.ipen.br/handle/123456789/28473. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Utilização de altas pressões hidrostáticas para o estudo e renaturação de proteínas com estrutura quaternária / Utilization of high hydrostatic pressure for the study and refolding of proteins with quaternary structure . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 106 p. Orientador: Ligia Ely Morganti Ferreira Dias. DOI: 10.11606/D.85.2012.tde-06032013-144803 Abstract: A produção de proteínas recombinantes é uma ferramenta essencial para a indústria biotecnológica e suporta a expansão da pesquisa biológica moderna. Uma variedade de hospedeiros pode ser utilizada para produzir estas proteínas e dentre eles, as bactérias E. coli são as hospedeiras mais utilizadas. No entanto, a expressão heteróloga de genes em E. coli frequentemente resulta em um processo de enovelamento incompleto que leva ao acúmulo de agregados insolúveis, conhecidos como corpos de inclusão (CI). Altas pressões hidrostáticas são capazes de desfavorecer interações intermoleculares hidrofóbicas e eletrostáticas, levando à dissociação dos agregados e por isso são úteis para solubilizar e renaturar proteínas agregadas em CI. O presente trabalho teve como objetivo o estudo do processo de desagregação dos CI e de renaturação das proteínas oligoméricas subunidade B da toxina colérica (CTB) e região globular da fibra adenoviral (RGFA) utilizando altas pressões hidrostáticas. A toxina colérica (CT) é composta por uma subunidade A e cinco subunidades B combinadas em uma holotoxina AB5. A CTB é a porção pentamérica não tóxica da CT, responsável pela ligação da holotoxina ao receptor gangliosídeo GM1. A fibra do adenovírus é uma proteína homotrimérica que forma parte do capsídeo viral, organizada em três regiões: a cauda N-terminal, a haste central e a região C-terminal (região globular). A RGFA se liga à proteína de membrana CAR nas células hospedeiras e promove a internalização do vírus. Os estudos apresentados neste trabalho demonstraram que a alta pressão hidrostática foi eficaz na desagregação dos CI da CTB e da RGFA. As condições de renaturação foram otimizadas utilizando-se diferentes proporções do par redox glutationa oxidada e reduzida, concentrações de agentes caotrópicos, presença de aditivos e esquemas diferenciados de compressão/descompressão daqueles previamente descritos na literatura. CTB solúvel e pentamérica foi obtida pela compressão da suspensão de CI a 2,4 kbar por 16 horas em tampão TrisHCl 50 mM pH 8,5, 1 mM de tween 20 e descompressão direta seguida de incubação em pressão atmosférica. O rendimento de renaturação da CTB solúvel e pentamérica foi de até 45 % e 288 mg de CTB/litro de cultura bacteriana. Esta proteína apresentou estrutura regular e atividade biológica. RGFA trimérica foi obtida pela compressão da suspensão de CI em tampão TrisHCl 50 mM pH 8,0 e 0,5 M de L-arginina a 2,4 kbar por 1,5 horas e 0,4 kbar por 16 horas antes da completa descompressão. O rendimento de proteína solúvel trimérica da RGFA foi de 4 %, porém não foi possível obter a atividade biológica desta proteína.
Palavras-Chave: proteins; bacteria; escherichia coli; inclusions; hydrostatics; pressurization
. Utilização de altas pressões hidrostáticas para o estudo e renaturação de proteínas com estrutura quaternária. Orientador: Ligia Ely Morganti Ferreira Dias. 2012. 106 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-06032013-144803. Disponível em: http://repositorio.ipen.br/handle/123456789/10161. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-20 de 20
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

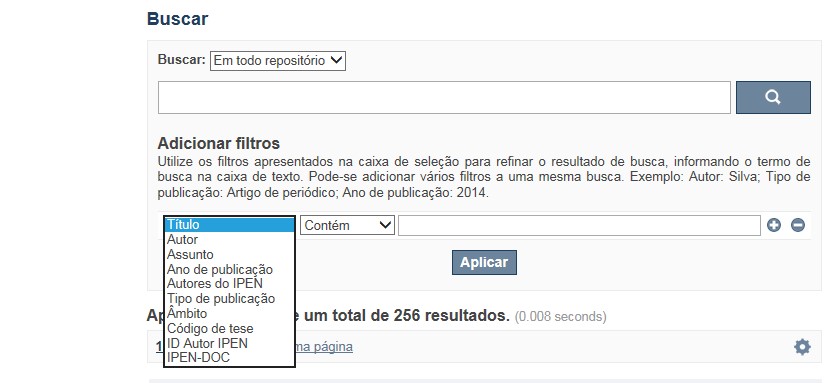
A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
