Navegação Teses por assunto "lth"
- Página inicial
- →
- IPEN
- →
- Teses
- →
- Navegação Teses por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação Teses por assunto "lth"
Itens para a visualização no momento 1-14 de 14
-
. Adaptação de células CHO secretoras de prolactina humana e seus antagonistas para o crescimento em suspensão / Adaptation of CHO cells secreting human prolactin and their antagonists to growth in suspension . 2011. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 73 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2011.tde-20062011-110202 Abstract: O Grupo de Hormônios do Centro de Biotecnologia do IPEN desenvolveu várias linhagens de células de ovário de hamster chinês (CHO) modificadas geneticamente e comprovadamente eficientes na expressão de proteínas heterólogas, dentre elas a prolactina humana (hPRL) e os análogos antagonistas de prolactina (S179D-hPRL e G129R-hPRL). No entanto, todas as linhagens para expressão são cultivadas em monocamadas e dependentes da presença de soro fetal bovino (SFB) no meio de cultivo para um crescimento eficiente. As células em suspensão apresentam um grande interesse industrial-farmacêutico, tanto pela facilidade de cultivo e ampliação de escala, como pela produtividade volumétrica. Desenvolvemos um protocolo para adaptação de células CHO para o crescimento em suspensão e também processos de produção em frascos spinners. Nesse trabalho foi realizada a adaptação das linhagens produtoras de hPRL; S179D-hPRL e G129R-hPRL para o crescimento em suspensão e em meio livre de SFB. Realizamos também a produção em escala laboratorial com as três linhagens adaptadas, assim como a correspondente purificação e caracterização de quatro proteínas heterólogas, incluindo a prolactina humana glicosilada (G-hPRL).
Palavras-Chave: lth; cho cells; growth
. Adaptação de células CHO secretoras de prolactina humana e seus antagonistas para o crescimento em suspensão. Orientador: Carlos Roberto Jorge Soares. 2011. 73 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2011.tde-20062011-110202. Disponível em: http://repositorio.ipen.br/handle/123456789/9623. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Caracterização da estrutura oligossacarídica de prolactina glicosilada humana (G-hPRL) nativa e recombinante / Characterization of the oligosaccharide structure of human glycosylated prolactin (G-hPRL) native and recombinant . 2013. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 81 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2013.tde-04072013-161538 Abstract: A prolactina humana (hPRL) é um hormônio polipeptídico secretado pela hipófise anterior sob regulação do hipotálamo, envolvido em uma variedade de processos biológicos como o desenvolvimento da glândula mamária e lactação. O produto recombinante é importante no diagnóstico médico e no tratamento de insuficiência da lactação. Este hormônio pode ocorrer sob a forma de proteína não glicosilada (NG-hPRL) e glicosilada (G-hPRL), com pesos moleculares de aproximadamente 23 e 25 kilodalton (kDa), respectivamente; possui um único sítio de N-glicosilação localizado na asparagina (Asn) posição 31, que é parcialmente ocupado, representando assim um modelo particularmente interessante de glicosilação. A atividade biológica da G-hPRL é muito menor comparada à NG-hPRL (~4 vezes) e sua função fisiológica ainda não é bem definida: a porção de carboidrato parece ter um importante papel na biossíntese, secreção, atividade biológica, e sobrevivência plasmática do hormônio. O objetivo principal desse trabalho foi comparar as estruturas dos N-glicanos presentes na prolactina glicosilada hipofisária (G-hPRL-NHPP) com a recombinante. Para obter a G-hPRL recombinante foi realizada uma produção em escala laboratorial a partir de células de ovário de hamster chinês (CHO) geneticamente modificadas e adaptadas ao crescimento em suspensão. Foi adicionada, ao meio de cultura cicloheximida (CHX), cujo efeito principal foi aumentar a relação G-hPRL/NGhPRL que passou de 5% para 38%, facilitando assim a purificação da G-hPRL. A G-hPRL foi purificada em duas etapas, uma troca catiônica seguida de purificação por cromatografia liquida de alta eficiência de fase reversa (RP-HPLC) que se demonstrou eficiente na separação das duas isoformas de hPRL. A G-hPRL recombinante IPEN foi assim analisada por diversas técnicas confirmando a sua pureza e atividade biológica, incluindo comparações com outras amostras de referências de origem hipofisária adquirida junto ao National Hormone & Peptide Program (NHPP-E.U.A.) . Foi realizada também a determinação inédita de Nglicanos presentes na G-hPRL produzida por células CHO e na G-hPRL nativa, produzida pela hipófise humana, possibilitando comparar as duas estruturas de carboidratos e alcançando assim uma das principais metas desse projeto. Entre as principais diferenças encontradas nas estruturas dos dois N-glicanos, destacam-se a baixa quantidade de ácido siálico (NeuAc), a alta porcentagem de glicanos sulfatos (74,0%) e com fucose (Fuc) (93,3%) presentes na amostra hipofisária e a tendência da preparação recombinante de apresentar glicanos com maior peso molecular e com uma menor variação nas isoformas.
Palavras-Chave: lth; hormones; mammary glands; lactation; recombinant dna; oligosaccharides; pituitary hormones; cho cells; high-performance liquid chromatography
. Caracterização da estrutura oligossacarídica de prolactina glicosilada humana (G-hPRL) nativa e recombinante. Orientador: Carlos Roberto Jorge Soares. 2013. 81 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2013.tde-04072013-161538. Disponível em: http://repositorio.ipen.br/handle/123456789/10212. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento de processo de fermentacao em biorreator para producao de prolactina humana secretada no espaco periplasmico de Escherichia coli / Development of the fermentation process in bioreactor for the production of human prolactin secreted in the periplasmic space of Escherichia coli . 2008. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 61 p. Orientador: Carlos Roberto Jorge Eduardo. DOI: 10.11606/D.85.2008.tde-07072009-152955 Abstract: A Prolactina (PRL) é um dos hormônios mais versáteis em termos de ação biológica. Sua ação mais conhecida está relacionada com o estímulo da lactação e regulação do crescimento e da diferenciação da glândula mamária; também apresenta importante aplicação diagnóstica. Somando os crescentes estudos sobre suas possíveis aplicações terapêuticas, fica cada vez mais notória a necessidade da obtenção desse hormônio puro, biologicamente ativo e na sua forma autêntica.O objetivo fundamental desse projeto foi a produção de hPRL em escala laboratorial a partir de bactérias (E.coli) modificadas geneticamente, utilizando um sistema de expressão baseado no promotor Lambda () PL, o mesmo utilizado com sucesso em nosso laboratório na expressão do hGH. Descrevemos nesse trabalho um processo de cultivo em biorreator, onde não foi utilizado o repressor cIts, uma proteína termo-sensível que usualmente é utilizada para inibir o funcionamento do promotor PL durante crescimento a 30ºC. O processo de cultivo apresenta basicamente três etapas: na primeira etapa o crescimento é realizado sem adição contínua de nutrientes (cultivo em batch), na segunda etapa ocorre adição contínua de nutrientes e carboidrato (cultivo em fed-batch) e na última etapa é realizada a ativação, caracterizada pelo aumento da temperatura mantendo-se a adição de nutrientes e carboidrato. Esse processo de fermentação rápido e flexível, com duração média de 20 horas, permitiu obter uma biomassa final correspondente à densidade óptica de aproximadamente 30 A600nm (unidades ópticas de absorbância em 600nm) e com uma expressão da ordem de 1g de hPRL mL-1 A600 -1, as mais altas já relatadas para secreção de prolactina no espaço periplásmico. A hPRL monomérica foi purificada e caracterizada por métodos físico-químicos e biológicos, os quais confirmaram a sua atividade biológica e imunológica, o seu correto processamento e uma massa molecular relativa (Mr) de 22.906.
Palavras-Chave: lth; escherichia coli; bioreactors; fermentation
. Desenvolvimento de processo de fermentacao em biorreator para producao de prolactina humana secretada no espaco periplasmico de Escherichia coli. Orientador: Carlos Roberto Jorge Eduardo. 2008. 61 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2008.tde-07072009-152955. Disponível em: http://repositorio.ipen.br/handle/123456789/11767. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo da expressao citoplasmica bacteriana de uma forma de prolactina humana e de sua solubilizacao e renaturacao a partir de corpos de inclusao. 2000. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 105 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; escherichia coli; cytoplasm; bacteriophages; recombinant dna; separation processes; solubility; purification; hormones; genes; bacteria
. Estudo da expressao citoplasmica bacteriana de uma forma de prolactina humana e de sua solubilizacao e renaturacao a partir de corpos de inclusao. Orientador: Paolo Bartolini. 2000. 105 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10835. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo dos perfis de N-glicosilação da prolactina recombinante humana expressa em células humanas HEK293 / Study of N-glycosylate profiles of human recombinant prolactin expressed in human cells HEK293 . 2018. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 75 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2018.tde-28092018-142442 Abstract: A prolactina humana (hPRL) é um hormônio sintetizado pela hipófise com inúmeras funções tais como: lactação, reprodução e regulação osmótica. Este hormônio é frequentemente dosado em casos de problemas na lactação, infertilidade, além de estudos que elucidam sua ligação em alguns tipos de câncer (mama, próstata e útero). A hPRL é encontrada na forma não glicosilada (NG-hPRL) (23 kDa) e glicosilada (G-hPRL) (25 kDa), sendo a isoforma glicosilada um modelo ideal de análise de perfil de N-glicanos, já que possui um único sítio de glicosilação localizado na Asparagina 31. A glicosilação está relacionada diretamente à solubilidade, à estabilidade, ao enovelamento, à meia-vida e atividade biológica in vivo. As células de ovário de hamster chinês (CHO) e as células embrionárias de rim humano (HEK293) são os hospedeiros mais utilizados para expressão de proteínas recombinantes, já que podem ser cultivadas em altas densidades e por possuírem similaridade nas modificações pós-traducionais. O objetivo foi expressar, purificar e realizar uma caracterização físico-química e biológica da hPRL glicosilada de células HEK293, incluindo análise da estrutura de carboidratos. Para tanto, foi realizada uma transfecção em células HEK293T (aderidas) com o vetor pcDNA 3.4-TOPO. Foi obtida uma expressão de 21,26 ± 8,3 μg/mL de hPRL no meio condicionado sem soro. A hPRL foi purificada por cromatografia de afinidade a metais imobilizados (IMAC), eluindo 92% da hPRL em uma única fração que, analisada por HPSEC, apresentou pureza de 97%. O perfil de N-glicanos da amostra apresentou seis espécies, todas com terminação em ácido-siálico, do tipo complexo, sendo bi, tri e tetra-antenárias, com relativa predominância da espécie N2G2S1 (29,4%). A bioatividade in vitro da G-hPRL HEK293 demonstrou ser ≅ 16 vezes menor que a G-hPRL produzida em células CHO.
Palavras-Chave: embryonic cells; animal cells; kidneys; escherichia coli; glycosyl transferases; lth; gonadotropins; high-performance liquid chromatography
. Estudo dos perfis de N-glicosilação da prolactina recombinante humana expressa em células humanas HEK293. Orientador: Carlos Roberto Jorge Soares. 2018. 75 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2018.tde-28092018-142442. Disponível em: http://repositorio.ipen.br/handle/123456789/29634. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Influência da temperatura de cultivo na expressão de proteínas recombinantes de interesse terapêutico no espaço periplásmico bacteriano, utilizando o promotor lambda PL / Influence of the cultivation temperature on the expression of recombinant proteins of therapeutic interest in the periplasmic space, using lambda PL promoter . 2015. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 87 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/T.85.2015.tde-19102015-150711 Abstract: O sistema de expressão baseado nos promotores PL ou PR do fago lambda que usualmente é regulado pelo repressor termo lábil (cIts) é amplamente utilizado para produzir proteínas recombinantes em células procarióticas. No entanto, o aumento da temperatura requerido neste sistema para promover a inativação do repressor apresenta algumas limitações, como o aumento da expressão de proteínas de HSP (Heat Shock Proteins), por exemplo, proteases, que dependendo da natureza da proteína expressa podem ser prejudiciais ou não. Uma outra limitação é a ativação da resposta SOS, resultando na parada da replicação do DNA celular ou dependendo da cepa pode ocorrer lise celular. Nesse trabalho nós descrevemos o uso do promotor λPL para expressão constitutiva, isto é, sem a regulação do repressor. Nós otimizamos diferentes condições de cultura para aumentar a secreção no espaço periplásmico de Escherichia coli de cinco proteínas: o hormônio do crescimento humano (hGH), que tem sido amplamente utilizado no tratamento de crianças com deficiência e/ou resistência ao hGH, síndrome de Turner, entre outras desordens; prolactina humana (hPRL), um hormônio polipeptídico conhecido por estimular a lactação e por exercer ação regulatória no crescimento e na diferenciação da glândula mamária, dois antagonistas de hPRL, estudados como potenciais fármacos para o tratamento de alguns tipos de cânceres e por fim o interferon α2a (IFN-α2a), que é uma citocina produzida pelas células, em resposta a diferentes estímulos, incluindo ácidos nucléicos virais, células estranhas (particularmente as neoplásicas), antígenos de bactérias, protozoários e vírus. No caso do IFN-α2a, essa citocina de alto valor agregado e de importante aplicação terapêutica, foi desenvolvida em nosso laboratório como parte desse trabalho, incluindo o desenvolvimento e a validação da metodologia de análise por HPLC de fase reversa para determinação do IFN presente no fluído periplásmico bacteriano ou na sua forma pura. As principais estratégias utilizadas para melhorar a expressão foram iniciar a indução junto à densidade óptica máxima do crescimento bacteriano e otimizar a temperatura de indução para controlar a expressão da proteína heteróloga. Essa metodologia pode ser utilizada nos casos onde o produto não será tóxico para a célula hospedeira ou quando a instabilidade do plasmídeo não é problema. A possibilidade de cultivo em temperaturas mais baixas, já que o repressor termo-sensível não se encontra presente, colaborou para o aumento significativo da expressão, mesmo para proteínas menos sensíveis à temperatura de cultivo, como o hGH.
Palavras-Chave: recombinant dna; proteins; escherichia coli; sth; lth; peptide hormones; plasmids; chromatography
. Influência da temperatura de cultivo na expressão de proteínas recombinantes de interesse terapêutico no espaço periplásmico bacteriano, utilizando o promotor lambda PL. Orientador: Carlos Roberto Jorge Soares. 2015. 87 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2015.tde-19102015-150711. Disponível em: http://repositorio.ipen.br/handle/123456789/25195. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Miniextracao e purificacao da prolactina humana para preparacao de reagentes usados em radioimunoensaio. 1989. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 117 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; radioimmunoassay; purification
. Miniextracao e purificacao da prolactina humana para preparacao de reagentes usados em radioimunoensaio. Orientador: Paolo Bartolini. 1989. 117 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10213. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Padronizacao de um metodo de HPLC em fase reversa para determinacao de prolactina em extratos bacteriano e em sua forma purificada: sua aplicacao em estudo colaborativo internacional promovido pela O.M.S. 2002. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 58 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; purification; escherichia coli; high-performance liquid chromatography; accuracy
. Padronizacao de um metodo de HPLC em fase reversa para determinacao de prolactina em extratos bacteriano e em sua forma purificada: sua aplicacao em estudo colaborativo internacional promovido pela O.M.S. Orientador: Paolo Bartolini. 2002. 58 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/11076. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Preparacao e caracterizaco das subunidades alfa e beta dos hormonios glicoproteicos humanos recombinantes: foliculotrofina, luteotrofina, tireotrofina e sua comparacao com os produtos hipofisarios / Preparation and characterization of alpha and beta subunits of recombinant human glycoprotein hormones: folliclestimulating hormone, luteotropin, thyrotrophin and their comparison with pituitary glycoprotein hormones . 2008. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 74 p. Orientador: Maria Teresa de Carvalho Pinto Ribela. DOI: 10.11606/D.85.2008.tde-10102011-143435 Abstract: Neste trabalho é descrito um método prático e eficiente para dissociar, em subunidades α e β, quantidades pequenas (da ordem de microgramas) dos hormônios foliculotrofina (hFSH), luteotrofina (hLH) e tireotrofina (hTSH) humana, nativos e recombinantes. A dissociação destes hormônios foi conseguida incubando-os, durante 16 horas, a 37ºC, com diferentes concentrações de ácido acético: 3M, 5M e 0,4M respectivamente para o hFSH, hLH e hTSH. Nestas condições, uma eficiência de dissociação acima de 98% foi obtida. Esta eficiência foi calculada com base nas determinações de massa dos heterodímeros e das subunidades, realizadas por MALDI-TOF-MS. Uma separação rápida e quantitativa das subunidades, com rendimentos da ordem de 80-90%, foi conseguida por cromatografia líquida de alta eficiência em fase reversa (RP-HPLC) em uma coluna C4. As subunidades foram caracterizadas quanto à pureza, hidrofobicidade, massa molecular e distribuição de carga por HPLC de exclusão molecular e fase reversa, SDS-PAGE e focalização isoelétrica. Quando analisadas quanto à hidrofobicidade, as subunidades mostraram-se aproximadamente iguais, enquanto as subunidades β dos três heterodímeros apresentaram a seguinte escala de hidrofobicidade: β-hFSH < β-hTSH < β-hLH. Com relação à massa molecular relativa (Mr), as subunidades α e β do hFSH apresentaram as maiores Mr enquanto as subunidades do hLH as menores. A distribuição dos isômeros de carga das subunidades dos três hormônios ocorreu em uma região ácida, para o hFSH, em uma região básica, para o hLH e em uma região intermediária, para o hTSH. As subunidades α dos três hormônios, quando analisadas via SDS-PAGE, apresentaram praticamente a mesma mobilidade eletroforética, enquanto as subunidades β apresentaram diferentes taxas de migração (mR), sendo mR β-hFSH < mR β-hTSH < mR β-hLH. Diferenças relativas à massa molecular, hidrofobicidade, migração eletroforética e distribuição de carga foram encontradas entre as preparações recombinantes e hipofisárias dos três hormônios. O método descrito é suave, prático e flexível e pode ser adaptado à dissociação de outras glicoproteínas heterodiméricas recombinantes ou nativas. Permite não só estudos e caracterização direta de cada subunidade, como também detectar a presença de subunidades livres em preparações farmacêuticas, que são contaminantes indesejáveis, sendo, portanto, uma ferramenta extremamente útil para o controle de qualidade de produtos farmacêuticos.
Palavras-Chave: hormones; glycoproteins; fsh; lth; trh; pituitary hormones; glycoproteins; mass spectroscopy; high-performance liquid chromatography
. Preparacao e caracterizaco das subunidades alfa e beta dos hormonios glicoproteicos humanos recombinantes: foliculotrofina, luteotrofina, tireotrofina e sua comparacao com os produtos hipofisarios. Orientador: Maria Teresa de Carvalho Pinto Ribela. 2008. 74 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2008.tde-10102011-143435. Disponível em: http://repositorio.ipen.br/handle/123456789/11752. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Producao de prolactina humana autentica por tecnicas de DNA recombinante. 1993. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 90 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; production; recombinant dna; radioimmunoassay; hormones; escherichia coli; diagnostic techniques; sth; proteins; plasmids
. Producao de prolactina humana autentica por tecnicas de DNA recombinante. Orientador: Paolo Bartolini. 1993. 90 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10351. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Prolactina humana pseudofosforilada (S179D-hPRL) é um potente fator anti-angiogênico in vitro e in vivo. 2006. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. p. Orientador: Paolo Bartolini. DOI: 10.11606/T.85.2006.tde-28052007-162443 Abstract: S179D prolactina (hPRL) é uma mímica molecular da prolactina humana fosforilada. Demonstrou-se que a S179D-hPRL era anti angiogênica nos ensaios de angiogênese baseados na membrana corialantóica de galinha e na córnea de camundongos. Investigações posteriores realizadas empregando modelos in vitro demonstraram que o tratamento com S179D-hPRL diminuiu o número de células viáveis, reduziu a formação de túbulos em Matrigel e interferiu com a migração e invasão da matriz extracelular. A análise dos fatores de crescimento de células endoteliais humanas tratadas com S179D-hPRL revelou: uma diminuição na expressão ou liberação da PRL endógena, da heme-oxigenase-1, do fator de crescimento de fibroblasto básico (bFGF) e um aumento na expressão de dois inibidores teciduais de metaloproteases. A S179D-hPRL também bloqueou a sinalização provocada por bFGF nessas células. Nós concluímos que essa mímica molecular do hormônio pituitário fosforilado é uma potente proteína anti-angiogênica, em parte devido á sua habilidade de reduzir o estímulo autócrino de fatores de crescimento de células endoteliais de cordão umbilical humano (HUVEC), por sua capacidade de bloquear a sinalização promovida pelo bFGF e por sua habilidade de interferir na migração endotelial. Também foi estudada a influência da S179D-hPRL na apoptose em células endoteliais humanas, empregando caspase-8 como um marcador da via extrínseca, e a liberação de citocromo C como um marcador da via intrínseca. As duas cascatas convergem na ativação da caspase-3, que cliva a fator de fragmentação de DNA (DFF45). Uma incubação de três dias com 50 ng/mL de S179D-hPRL quadruplicou o número de células apoptóticas; esse efeito duplicou-se com uma concentração de 100 ng/mL e atingiu um ápice com 500 ng/mL. A clivagem de DFF45 e da pro-caspase-8 foi detectado com 100 ng/mL. Citocromo C, porém, só foi observado com concentrações de 500 ng/mL. O regulador de ciclo celular p21 (um marcador pró-apoptótico) elevou-se com 100 ng/mL, enquanto que um incremento do supressor tumoral p53 necessitou três vezes o tempo de incubação e 500 ng/mL. A atividade do promotor de p21 foi máxima com 50 ng/mL do análogo de hPRL, enquanto que 500 ng/mL foram necessários para se visualizar uma alteração significativa na atividade do promotor de Bax (um indicador da atividade de p53). Como previamente demonstrado na literatura, S179D-hPRL bloqueou a fosforilação da quinase regulada extracelularmente (ERK) em resposta ao bFGF, mas também causou uma ativação tardia e prolongada da ERK. PD 98059 [inibidor específico da proteína quinase ativada por mitógeno (MAPkinase)] inibiu essa ativação tardia e sustentada assim como outros efeitos da S179D-hPRL, exceto aquele sobre a indução de p53 e ativação do promotor de Bax. Podemos concluir que baixas doses de S179D-hPRL bloqueiam a sinalização de ERK induzida por bFGF e concomitantemente ativam a ERK em um tempo diferente, resultando na elevação de p21 e ativando a via extrínseca de apoptose. Maiores tempos de incubação e concentração, entretanto, ativam a via intrínseca empregando uma cascata intracelular diferente. Esses achados sugerem que níveis circulantes de PRL fosforilada podem inibir a progressão do câncer e, portanto, S179D-hPRL poderia ser um agente anti-angiogênico útil na terapêutica.
Palavras-Chave: lth; phosphorylation; peptide hormones; cell proliferation; neoplasms; cell differentiation; polypeptides; endothelium; apoptosis; growth factors; receptors; antigens; in vitro; in vivo; proteins
. Prolactina humana pseudofosforilada (S179D-hPRL) é um potente fator anti-angiogênico in vitro e in vivo. Orientador: Paolo Bartolini. 2006. f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/T.85.2006.tde-28052007-162443. Disponível em: http://repositorio.ipen.br/handle/123456789/11441. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Sintese de prolactina humana em celulas de ovario de hamster chines (CHO). 2000. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. 94 p. Orientador: Paolo Bartolini.
Palavras-Chave: lth; synthesis; cho cells; gene recombination; gene amplification; radioimmunoassay; synthesis; somatic cells; tracer techniques; pituitary hormones; peptide hormones; cell cultures; cloning
. Sintese de prolactina humana em celulas de ovario de hamster chines (CHO). Orientador: Paolo Bartolini. 2000. 94 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN/CNEN-SP, Sao Paulo. Disponível em: http://repositorio.ipen.br/handle/123456789/10770. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Síntese e caracterização de prolactina de camundongo (mPRL) e de seu análogo (S177D-mPRL) / Synthesis and characterization of mouse prolactin mPRL) and of its anlog (S177D-mPRL) . 2011. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 98 p. Orientador: Carlos Roberto Jorge Borges. DOI: 10.11606/T.85.2011.tde-29062011-154905 Abstract: A prolactina é um neurohormônio que faz parte da superfamília das citocinas e está envolvida em inúmeros processos biológicos. Devido à sua ação endócrina, autócrina e parácrina, a prolactina está muitas vezes relacionada ao desenvolvimento de patogenias humanas como carcinomas e doenças autoimunes. Considerando-se que: a) diferença de 41% encontrada na sequência de aminoácidos da prolactina de camundongo em relação à humana, b) diferenças na glicosilação, fosforilação, e ligação ao receptor e, c) o fato que os modelos animais utilizados em ensaios in vivo com prolactina humana são geralmente ratos ou camundongos (modelos heterólogos), fica evidente que esses fatores podem interferir na interpretação dos resultados. Portanto, experimentos em sistemas homólogos seriam desejáveis. Esse trabalho descreve a obtenção pela primeira vez da mPRL no espaço periplásmico bacteriano, portanto na sua forma autêntica, ou seja, sem a metionina inicial, com expressão de 0,1 ± 13,2% g/mL/A600. Para isso um vetor de expressão baseado no promotor lPL foi construído e utilizado como promotor constitutivo, com ativação a 37° C. Um processo de fermentação em biorreator, com rendimentos de expressão de até 2,5 g/mL, e um processo de purificação com três etapas: concentração e purificação por hidrofobicidade (Phenyl Sepharose CL-4B) seguida por HPLC de fase reversa e HPSEC, foram também desenvolvidos. A mPRL purificada foi caracterizada por técnicas físico-químicas e biológicas em comparação com o padrão de referência da mPRL recombinante do Instituto Nacional de Saúde (NIH, EUA). A atividade biológica foi analisada e sua potência calculada foi de 33,9 ± 1,4 UI/mg. O mesmo vetor foi utilizado para a expressão do antagonista S177DmPRL, mas o baixo nível de expressão obtido inviabilizou a sua produção no espaço periplásmico de bactérias. Como alternativa, optamos por produzir essa proteína em células CHO e clones com expressão da ordem de 1 g/mL/dia foram obtidos. Com a expressão tanto da mPRL autêntica, como do S177D-mPRL, está aberto o caminho para o desenvolvimento dos estudos que envolvam modelos animais onde a mPRL e seu antagonista sejam fatores relevantes a serem considerados.
Palavras-Chave: lth; rats; synthesis; cho cells; recombinant dna; hormones; high-performance liquid chromatography
. Síntese e caracterização de prolactina de camundongo (mPRL) e de seu análogo (S177D-mPRL). Orientador: Carlos Roberto Jorge Borges. 2011. 98 f. Tese (Doutoramento) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/T.85.2011.tde-29062011-154905. Disponível em: http://repositorio.ipen.br/handle/123456789/9955. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Utilizacao de celulas CHO cultivadas na presenca de cicloheximida para obtencao e caracterizacao de prolactina humana glicosilada (G-hPRL) recombinante / Utilization of CHO cells cultivated in presence of cycloheximide for obtainment and characterization of recombinant human glycosylated prolactin (G-hPRL) . 2008. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 73 p. Orientador: Carlos Roberto Jorge Soares. DOI: 10.11606/D.85.2008.tde-07072009-160412 Abstract: A Prolactina humana hPRL é um hormônio protéico com 199 aminoácidos (MM ~ 23.000 Da) com um amplo espectro de atividades biológicas, sendo mais conhecido por estimular a lactação e regular o crescimento e diferenciação da glândula mamária. Além de quebra proteolítica, a maioria dos variantes de prolactina podem ser resultantes de outros processos pós-traducionais como polimerização, fosforilação, desamidação, sulfatação e glicosilação. Essa proteína contém apenas um sítio potencial de glicosilação por ligação à asparagina, localizada no aminoácido 31, que é parcialmente ocupado (10%) quando a proteína é sintetizada em células eucariotas. Apesar da atividade biológica in vitro da prolactina glicosilada (G-hPRL) ser muito menor (~4 vezes) quando comparada à não glicosilada, sua função fisiológica ainda não é bem definida e a porção de carboidrato parece ter um importante papel na biossíntese, secreção, atividade biológica, e clearance plasmático do hormônio. Com o objetivo de melhor caracterizar e estudar esta variante hormonal, foi realizada sua purificação em escala laboratorial a partir de células de ovário de hamster chinês (CHO) modificadas geneticamente, utilizando meio de cultura suplementado com cicloheximida, aumentando ~4 vezes sua concentração absoluta e ~10 vezes a razão entre a isoforma glicosilada e a não-glicosilada. A purificação da G-hPRL seguiu um processo simples e efetivo de duas etapas principais baseado em uma coluna de troca catiônica e uma coluna preparativa de exclusão molecular acoplada a um sistema de cromatografia líquida de excusão molecular de alta eficiência (HPSEC). A caracterização foi feita por HPLC de fase reversa (RP-HPLC) e exclusão molecular, SDS-PAGE, Western Blotting, espectometria de massa (MALDI-TOF) e um bioensaio in vitro utilizando células Nb2 e Ba/F3-LLP. Nossos resultados demostram que a cicloheximida pode ser uma importante ferramenta para aumentar a produção de prolactina glicosilada, facilitando a purificação e caracterização dessa isoforma.
Palavras-Chave: lth; purification; recombinant dna; cho cells; cycloheximide
. Utilizacao de celulas CHO cultivadas na presenca de cicloheximida para obtencao e caracterizacao de prolactina humana glicosilada (G-hPRL) recombinante. Orientador: Carlos Roberto Jorge Soares. 2008. 73 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2008.tde-07072009-160412. Disponível em: http://repositorio.ipen.br/handle/123456789/11738. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-14 de 14
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
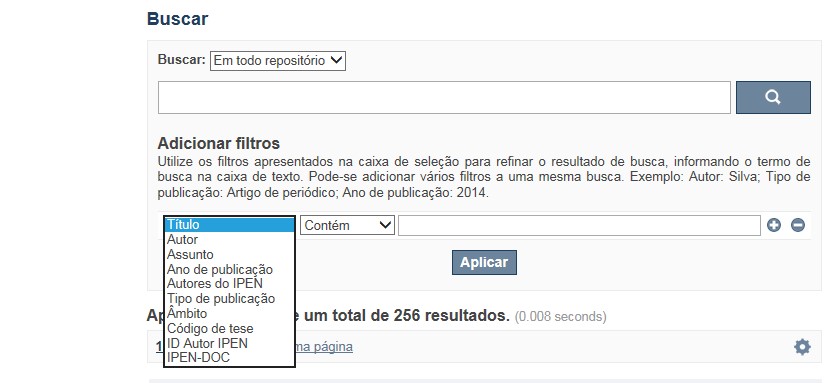
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
