Navegação Teses por assunto "validation"
- Página inicial
- →
- IPEN
- →
- Teses
- →
- Navegação Teses por assunto
- Sobre
- Perfil Técnico
- Política de funcionamento
- Ajuda
- Apresentação
Navegação Teses por assunto "validation"
Itens para a visualização no momento 1-20 de 30
-
. Avaliação de interferentes endócrinos e marcadores de atividade antrópica nos corpos d'água da área de instalação do Reator Multipropósito Brasileiro - RMB / Evaluation of endocrine disruptors and anthropic activity markers in water bodies of the area of installation of the Brazilian Multipurpose Reactor - BMR . 2018. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 204 p. Orientador: Marycel Elena Barboza Cotrim. DOI: 10.11606/D.85.2019.tde-15022019-143422 Abstract: O estudo de poluentes com características orgânicas e inorgânicas nas águas subterrâneas e superficiais de uma dada região é uma ferramenta importante na avaliação da poluição. Os interferentes endócrinos são produtos químicos sintéticos ou naturais que têm a capacidade de atuar no sistema endócrino de seres humanos e animais mimetizando hormônios naturais estimulando respostas diferentes das que originalmente seriam geradas e podem produzir efeitos adversos sobre os organismos, mesmo em concentrações de μg e ng L-1. As atividades antrópicas são a principal fonte de entrada de interferentes endócrinos no meio ambiente. O objetivo desta pesquisa foi determinar 13 compostos orgânicos (dietilftalato, dibutilftalato, nonilfenol, bisfenol A, cafeína, androstano, estrona, estradiol, etinilestradiol, progesterona, coprostanol, colesterol e colestanol) que podem estar presentes nas águas subterrâneas e superficiais da área de instalação do Reator Multipropósito Brasileiro (RMB). Este é um estudo sem precedentes e de grande importância para a região avaliada, uma vez que fornecerá orientação sobre o grau de contaminação das águas locais antes do início do projeto de construção. O estudo também permitirá verificar se o projeto de construção do reator oferecerá algum prejuízo ambiental para a área em seu entorno. Para a determinação dos compostos de interesse, foi utilizado um método analítico desenvolvido e validado para determinação dos compostos de interesse em amostras de água e particulado da coluna d'água, consistindo na concentração das amostras por extração em fase sólida (SPE) e/ou extração ultrassônica, seguido de quantificação por cromatografia gasosa acoplada a detector de espectrometria de massa (GC/MS). Os resultados revelaram baixas concentrações de alguns dos compostos orgânicos estudados, derivados de atividades antrópicas nas proximidades do local. Os rios que atravessam a área do projeto de instalação apresentam a maioria dos valores abaixo de 0,05 μg L-1, normalmente em estação seca, exceto para cafeína, em outubro de 2016 (0,80±0,03 μg L-1 a jusante do empreendimento) e outubro de 2017 (0,22±0,01 μg L-1 a jusante do empreendimento) e para colesterol em outubro de 2017 a montante do empreendimento (6,6±0,3 μg L-1).
Palavras-Chave: water treatment; organic compounds; detection; biogeochemistry; sample preparation; water pollution; rmb reactor; nuclear facilities; endocrine diseases; endocrine glands; hormones; metrology; validation; sensitivity; socio-economic factors; gas chromatography; mass spectroscopy; high-performance liquid chromatography; x-ray diffraction
. Avaliação de interferentes endócrinos e marcadores de atividade antrópica nos corpos d'água da área de instalação do Reator Multipropósito Brasileiro - RMB. Orientador: Marycel Elena Barboza Cotrim. 2018. 204 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2019.tde-15022019-143422. Disponível em: http://repositorio.ipen.br/handle/123456789/29792. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Avaliação do teor de carbono orgânico total na qualidade da água: aplicação na radiofarmácia / Evaluation of total organic carbon content in the quality of the water: application in radiopharmacy . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 107 p. Orientador: Margareth Mie Nakamura Matsuda. DOI: 10.11606/D.85.2012.tde-12022014-104943 Abstract: Radiofármacos são preparações farmacêuticas que possuem um radionuclídeo em sua composição. Cerca de 95% deles são utilizados com finalidade diagnóstica e em sua maioria são administrados por via parenteral, requerendo o uso de água purificada (AP) e para injeção (API) nos processos de produção, controle de qualidade e pesquisa de novos radiofármacos. A produção de radiofármacos no Brasil deve atender às Boas Práticas de Fabricação (BPF), RDC n. 17/2010 e RDC n. 63/2009 da ANVISA e requisitos de qualidade definidos pelas farmacopeias vigentes. Considerando que os volumes dos lotes de fabricação de radiofármacos são reduzidos, de algumas dezenas a centenas de mililitros, e a sua validade é de algumas horas a alguns dias, frequentemente tem sido utilizados sistemas purificadores de uso laboratorial para a produção de AP e API nas radiofarmácias. A determinação de carbono orgânico total (COT) é um dos requisitos a serem atendidos na avaliação da qualidade de AP e API e o seu limite é de 500 μg L-1. O objetivo deste estudo foi validar o método analítico de COT que combina reações de acidificação e de oxidação química do carbono para análise de carbono inorgânico (CI) e carbono total (CT), na análise de AP e API, avaliar o desempenho de sistemas de purificação de uso laboratorial para a produção de AP e API e comparar com a API adquirida de fornecedores externos. Utilizou-se um analisador de carbono modelo TOC-Vwp acoplado a um amostrador automático modelo ASI-V, ambos da marca Shimadzu® e controlados por software TOC Control-V e frascos de 40 mL lavados com HNO3 15%, com soluções de reagente oxidante (Na2S2O8 0,5 mol L-1) e acidificante (H3PO4 3,0 mol L-1), soluções de COT/CT (C8H5O4K) e CI (Na2CO3 e NaHCO3) nas concentrações 100-1000 μg L-1. Foram avaliados os parâmetros de validação de método: conformidade do sistema, robustez, repetibilidade, precisão intermediária, exatidão, linearidade e limites de detecção e quantificação. O desempenho de 5 sistemas de purificação foram avaliados, com amostragem de AP e API de 6 pontos (3 de AP e 3 de API) e foram analisados COT, condutividade, pH, contagem de aeróbios totais e endotoxina bacteriana (somente para API). As melhores condições de análise foram 2 mL de oxidante, 3% de acidificante, tempo de integração da curva de CT de 10 minutos e 3 minutos para CI. As curvas analíticas de CT e CI foram lineares nas faixas de concentrações analisadas, com a soma residual dos mínimos quadrados (r2) maior que 0,997. Os resultados de repetibilidade apresentaram valores entre 0,40 4,40%, a precisão intermediária por sua vez apresentou a seguinte variação, 0,65 a 4,63% e exatidão apresentou valores na faixa de 96,76-112,52%. Os limites de detecção (LD) e quantificação (LQ) foram 31,83 e 106,11 μg L-1 e 59,16 e 197,22 μg L-1, para CT e CI, respectivamente. A avaliação de desempenho dos purificadores indicam que um procedimento adequado de limpeza do reservatório de água é importante para manter a concentração de COT em cerca de 100 μg L-1. A análise de COT/CI pode ser utilizada como indicador da necessidade de manutenção do sistema purificador. Algumas API embaladas apresentaram COT acima de 500 μg L-1. O monitoramento de COT durante a avaliação de desempenho dos sistemas de uso laboratorial acoplados a reservatórios indicou que eles são equipamentos adequados para obtenção de AP e API em radiofarmácia.
Palavras-Chave: radiopharmaceuticals; carbon; organic matter; water quality; storage; purification; validation
. Avaliação do teor de carbono orgânico total na qualidade da água: aplicação na radiofarmácia. Orientador: Margareth Mie Nakamura Matsuda. 2012. 107 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-12022014-104943. Disponível em: http://repositorio.ipen.br/handle/123456789/10605. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Caracterização de fontes de referência para a calibração "in situ" de ativímetros com validação utilizando simulações de Monte Carlo / Characterization of reference sources for in situ calibration of activimeters with validation using Monte Carlo simulation . 2021. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 92 p. Orientador: Maria da Penha Albuquerque Potiens. DOI: 10.11606/D.85.2021.tde-31032022-110125 Abstract: De acordo com a norma CNEN-NN-3.05 (2013), um Serviço de Medicina Nuclear (SMN) deve conter pelo menos um ativímetro em operação, sendo este utilizado de modo obrigatório e diário. Visando assegurar que a rotina de procedimentos de um SMN não seja interrompida e evitando prováveis danos ao equipamento delicado e pesado para ser deslocado, pode-se justificar o favoritismo pela implantação de uma técnica de calibração "in situ". Neste trabalho foram caracterizadas quatro radionuclídeos, sendo eles ,67Ga, 201Tl, 131I e o ,99mTc, os mesmos foram medidos experimentalmente com a utilização de um ativímetro. As respostas obtidas foram comparadas através do penEasy, de uso geral, baseado no pacote PENELOPE Monte Carlo, com o objetivo de estudar a resposta câmara de ionização CRC-25R da marca CAPINTEC ao variar parâmetros que influenciam suas características de resposta. Os radionuclídeos em estudo apresentaram comportamentos similares entre eles através da simulação e um comportamento padrão nos resultados experimentais. A altura do ativímetro com maior eficiência depende do radionuclídeo e do volume dentro do frasco. No entanto, é necessário estabelecer fatores de correção para cada amostra, geometria e volume considerando as incertezas associadas. É possível observar uma relação entre o frasco e a distância do fundo do detector, que assume um comportamento crescente. A maior deposição de energia pode ser medida entre 5cm e 7cm em relação ao fundo do poço. A partir dessas alturas, os fótons começam a escapar do detector pela abertura do equipamento, reduzindo a eficiência do volume sensível em absorver os fótons em aproximadamente ±20%.
Palavras-Chave: monte carlo method; calculation methods; simulation; anemometers; in-situ processing; calibration; validation; nuclear medicine; metrology; comparative evaluations
. Caracterização de fontes de referência para a calibração "in situ" de ativímetros com validação utilizando simulações de Monte Carlo. Orientador: Maria da Penha Albuquerque Potiens. 2021. 92 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2021.tde-31032022-110125. Disponível em: http://repositorio.ipen.br/handle/123456789/33118. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Contaminação do solo e mobilidade de As, Cd, Mo, Pb e Zn em colunas de solo franco arenoso com cinza de carvão / Soil contamination and mobility of As, Cd, Mo, Pb and Zn in sandy loam soil columns with coal fly ash . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 149 p. Orientador: Iara Maria Carneiro de camargo. DOI: 10.11606/D.85.2012.tde-24082012-140027 Abstract: Elementos tóxicos podem provocar impacto na qualidade ambiental dos solos e representar risco à saúde humana. As cinzas leves de carvão são uma fonte de elementos tóxicos e são comumente dispostas de maneira inadequada sobre o solo nas proximidades das usinas termelétricas, onde esses elementos podem ser lixiviados pela chuva, transportados para as fontes de águas naturais e absorvidos pela fauna e flora do solo, podendo assim, entrar na cadeia alimentar humana. Neste estudo foi avaliada a mobilidade dos elementos As, Cd, Zn, Pb e Mo em colunas de solo franco arenoso com cinza de carvão da usina termelétrica de Figueira, Paraná. Para tanto, colunas de cinza de carvão, solo e solo coberto com cinza foram lixiviadas com uma solução ácida ao longo de 336 dias e as amostras de cinza, solo e percolado das colunas foram caracterizadas quanto à concentração dos elementos e propriedades físicas, químicas e mineralógicas. Os resultados obtidos mostraram que o Pb não foi lixiviado da cinza de carvão, indicando que a lixiviação de Pb da cinza de carvão não representa risco ambiental. O Cd foi o elemento mais retido pelo solo franco arenoso, seguido de As. O Mo foi lixiviado da cinza de carvão, mas não foi detectado no solo e nos percolados das colunas de solo+cinza. Nas condições de estudo, o Zn não representou risco ambiental. Observou-se também que a concentração de As no solo excedeu o valor de intervenção para área de proteção máxima estabelecido pela Companhia Ambiental do Estado de São Paulo (CETESB) e a concentração de Cd no solo excedeu o valor de qualidade de referência estabelecido pela mesma companhia ambiental.
Palavras-Chave: soils; soil conservation; environmental impacts; hazards; risk assessment; validation; toxicity; pollution
. Contaminação do solo e mobilidade de As, Cd, Mo, Pb e Zn em colunas de solo franco arenoso com cinza de carvão. Orientador: Iara Maria Carneiro de camargo. 2012. 149 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-24082012-140027. Disponível em: http://repositorio.ipen.br/handle/123456789/10123. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validacao de metodologia analitica para determinacao de hidrocarbonetos policiclicos aromaticos (HPAS) em sedimentos. Avaliacao da represa do Parque Pedroso, Santo Andre, SP / Development and validation of analytical methodology for determination of polycyclic aromatic hydrocarbons (PAHS) in sediments. Assessment of Pedroso Park dam, Santo Andre, SP . 2009. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 148 p. Orientador: Elaine Arantes Jardim Martins. DOI: 10.11606/D.85.2009.tde-23092011-153741 Abstract: Os hidrocarbonetos policíclicos aromáticos (HPAs) por serem considerados contaminantes persistentes, pela sua ubiqüidade no meio ambiente e pelo reconhecimento de sua genotoxicidade, têm estimulado atividades de pesquisa com o objetivo de determinar e avaliar as origens, transporte, transformação, efeitos biológicos e a acumulação em compartimentos de ecossistemas aquático e terrestre. Nesta dissertação, a matriz estudada foi o sedimento coletado na represa do Parque Pedroso em Santo André, SP. A técnica analítica empregada foi a cromatografia líquida em fase reversa com detector UV/Vis. O tratamento dos dados foi estabelecido durante o processo de desenvolvimento da metodologia para que houvesse confiabilidade nos resultados. As etapas envolvidas foram avaliadas usando o conceito da Validação de Ensaios Químicos. Os parâmetros selecionados para a validação analítica foram Seletividade, Linearidade, Intervalo de Trabalho, Sensibilidade, Exatidão, Precisão, Limite de Detecção, Limite de Quantificação e Robustez. Esses parâmetros apresentaram resultados satisfatórios, o que permite a aplicação da metodologia desenvolvida, sendo ainda um método simples que permite a minimização da contaminação e da perda de compostos por excesso de manipulação. Para os HPAs estudados não foram encontrados resultados positivos, acima do limite de detecção, em nenhuma das amostras coletadas na primeira fase. Já na segunda coleta foram encontradas pequenas alterações principalmente em acenaftileno, fluoreno e benzo[a]antraceno. Embora a área se encontre preservada, já se notam pequenos sinais de contaminação.
Palavras-Chave: polycyclic aromatic hydrocarbons; liquid column chromatography; ultraviolet spectrometers; validation; structural chemical analysis; sediments; surface waters; brazil
. Desenvolvimento e validacao de metodologia analitica para determinacao de hidrocarbonetos policiclicos aromaticos (HPAS) em sedimentos. Avaliacao da represa do Parque Pedroso, Santo Andre, SP. Orientador: Elaine Arantes Jardim Martins. 2009. 148 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2009.tde-23092011-153741. Disponível em: http://repositorio.ipen.br/handle/123456789/9469. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validacao de metodologia analitica para determinacao de hormonios, considerados disruptores endocrinos, nas aguas destinadas ao abastecimento publico na regiao do Rio Paraiba do Sul, SP / Development and validation of analytical methodology for endocrine disruptors hormones determination in water for public supply at region of Paraiba do Sul River, SP . 2010. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 178 p. Orientador: Elaine Arantes Jardim Martins. DOI: 10.11606/D.85.2010.tde-11082011-161209 Abstract: Os disruptores endócrinos são substâncias químicas, sintéticas ou naturais, capazes de interferir no sistema endócrino de seres humanos e animais. Pertencem à classe dos micro poluentes, pois mesmo em concentrações de μg e ng.L-1 causam efeitos adversos aos organismos a eles expostos. Os hormônios destacam-se dentre os disruptores endócrinos por serem compostos potencialmente ativos no sistema biológico e estão relacionados à origem de diversos tipos de cânceres. Esta dissertação teve por objetivo desenvolver e validar metodologia para determinar hormônios, considerados disruptores endócrinos, em amostras de água bruta e tratada da região da Bacia Hidrográfica do Rio Paraíba do Sul utilizando a técnica de cromatografia gasosa com detecção por espectrometria de massas. A população atendida pelas unidades da SABESP dessa região é de aproximadamente 11 milhões de habitantes. Através do processo de validação, a metodologia desenvolvida pode ser considerada seletiva, robusta, exata, linear e precisa para a análise proposta. Aplicando o procedimento analítico validado nas amostras coletadas, alguns dos compostos estudados puderam ser detectados tanto em água bruta como em água tratada permanecendo abaixo do limite de quantificação, exceto a cafeína que apresentou concentração média de 0,45 μg.L-1 em água bruta e 0,17 μg.L-1 em água tratada, observando-se indícios de contaminação principalmente nas épocas secas. Este projeto de pesquisa está vinculado a uma parceria entre o Instituo de Pesquisas Energéticas e Nucleares (IPEN) e a Companhia de Saneamento Básico do Estado de São Paulo (SABESP).
Palavras-Chave: brazil; water supply; endocrine diseases; hormones; drinking water; gas chromatography; sample preparation; validation; waste water; water treatment
. Desenvolvimento e validacao de metodologia analitica para determinacao de hormonios, considerados disruptores endocrinos, nas aguas destinadas ao abastecimento publico na regiao do Rio Paraiba do Sul, SP. Orientador: Elaine Arantes Jardim Martins. 2010. 178 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2010.tde-11082011-161209. Disponível em: http://repositorio.ipen.br/handle/123456789/9599. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validacao de metodologia para radiofarmacos de tecnecio-99m empregando cromatografia liquida de alta eficiencia (CLAE) / Development and validation of methodology for technetium-99m radiopharmaceuticals using high performance liquid chromatography (HPLC) . 2009. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. 134 p. Orientador: Margareth Mie Nakamura Matsuda. DOI: 10.11606/D.85.2009.tde-24092009-142057 Abstract: Radiofármacos são compostos, sem ação farmacológica, que têm na sua composição um radioisótopo e são utilizados em Medicina Nuclear para diagnóstico e terapia de várias doenças. No presente trabalho, foi feito o desenvolvimento e a validação de método analítico para análise dos radiofármacos SAH-99mTc, EC-99mTc, ECD-99mTc e Sestamibi-99mTc e algumas matérias-primas por cromatografia líquida de alta eficiência (CLAE). As análises foram realizadas em equipamento CLAE Shimadzu, modelo LC-20AT Prominence. Algumas impurezas foram identificadas pela adição de substância de referência. A validação do método foi realizada segundo os critérios da norma RE no 899/ 2003 da Agência Nacional de Vigilância Sanitária ANVISA. Os resultados dos ensaios de robustez dos métodos demonstraram que são necessários o controle das condições de fluxo, volume de amostra, pH da fase móvel e temperatura do forno. As curvas analíticas foram lineares nas faixas de concentrações analisadas, com coeficientes de correlações lineares (r2) maiores que 0,9995. Os resultados de precisão, exatidão e recuperação apresentaram valores na faixa de 0,07- 4,78%, 95,38- 106,50% e 94,40- 100,95%, respectivamente. Os limites de deteção (LD) e os limites de quantificação (LQ) variaram de 0,27 a 5,77 g mL-1 e 0,90 a 19,23 g mL-1, respectivamente. Os valores encontrados para SAH, EC, ECD e MIBI nos RL (reagente liofilizado) foram 8,95; 0,485; 0,986 e 0,974 mg L-1, respectivamente. A pureza radioquímica média para SAH-99mTc, EC-99mTc, ECD-99mTc e Sestamibi-99mTc foi (97,28 ± 0,09)%, (98,96 ± 0,03)%, (98,96 ± 0,03)% e (98,07 ± 0,01)%, respectivamente. Todos os parâmetros recomendados pela ANVISA foram avaliados e os resultados estão abaixo dos limites estabelecidos.
Palavras-Chave: nuclear medicine; radiopharmaceuticals; chromatography; high-performance liquid chromatography; technetium 99; validation
. Desenvolvimento e validacao de metodologia para radiofarmacos de tecnecio-99m empregando cromatografia liquida de alta eficiencia (CLAE). Orientador: Margareth Mie Nakamura Matsuda. 2009. 134 f. Dissertacao (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, Sao Paulo. DOI: 10.11606/D.85.2009.tde-24092009-142057. Disponível em: http://repositorio.ipen.br/handle/123456789/9403. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validação da metodologia SPE-LC-MS/MS para a determinação de fármacos e droga de abuso nas águas da represa Guarapiranga - São Paulo/SP, Brasil / Development and validation of methodology SPE-LC-MS/MS for pharmaceuticals and illicit drug determination in the waters of Guarapiranga dam - Sao Paulo/SP, Brazil . 2015. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 224 p. Orientador: Maria Aparecida Faustino Pires. DOI: 10.11606/T.85.2015.tde-28042015-095207 Abstract: Este estudo apresenta o desenvolvimento da metodologia de extração em fase sólida e separação em cromatográfica líquida acoplada a espectrometria de massas em sequencia, SPE-LC-MS/MS, para a determinação de 21 (vinte e um) fármacos pertencentes a diferentes classes terapeuticas, 1 (uma) droga de abuso e seu principal metabólito, em amostras de água superficial. A separação cromatográfica foi otimizada estudando o desempenho de fases estacionárias e fases móvies. A quantificação dos compostos selecionados foi realizada com a ionização por eletronebulização (electrospray ionization- ESI) e o espectrômetro de massas operando no modo de Monitoramento de Múltiplas Reações (Multiplas Reaction Monitoring- MRM). A validação da metodologia proposta foi realizada utilizando os parâmetros de seletividade, efeito de matriz, faixa de trabalho, linearidade, limites de detecção (LD) e quantificação (LQ), precisão, exatidão, recuperação e robustez. A validação da metodologia permitiu a sua aplicação na avaliação da distribuição dos 23 compostos selecionados, nas águas da represa Guarapiranga, um dos principais sistemas produtor de água potável da Região Metropolitana de São Paulo (RMSP). A presença desses poluentes nos ambientes aquáticos é proveniente da liberação direta do esgoto urbano das habitações do seu entorno, como consequência do precário sistema de saneamento básico. As águas da represa Guarapiranga foram avaliadas em 14 (quatorze) locais estrategicamente escolhidos e amostradas durante 3 (três) campanhas de coleta de amostra (agosto de 2011, setembro de 2012 e abril de 2013). Nessas amostras foram quantificados acetaminofeno (9,6 - 254 ng L-1), atenolol (8,5 177 ng L-1), benzoilegonina (7,9 139 ng L-1), cafeína (27 27386 ng L-1), carbamazepina (12 358 ng L-1), clortalidona (9,4 35 ng L-1), cocaína (12,8 2650 ng L-1), diclofenaco (8 35 ng L-1), enalapril (20 ng L-1), losartana (6,7 114 ng L-1) e valsartana (9,7 - 47 ng L-1). O ponto de coleta denominado de GU103-12 (23°4188.5S 46°4467.3W) foi a região que apresentou os valores mais elevados quanto ao nível de concentração dos compostos avaliados e ao índice de risco integrado de poluição química aquática (Integrated Risk Index of Chemical Aquatic Pollution IRICAP). O estudo também foi realizado em amostras de água de reservatórios das Unidades de Gerenciamento de Recursos Hídricos (UGRHI) 5 e 6 do Estado de São Paulo. Os resultados demonstraram que o uso e a ocupação do solo influenciam diretamente na qualidade da água dos reservatórios, evidenciando a necessidade de implementar melhorias no sistema de coleta de esgoto e de ocupação irregular para evitar a contaminação e o descarte inadequado em ambientes aquáticos.
Palavras-Chave: brazil; dams; surface waters; sample preparation; drugs; contamination; liquid column chromatography; mass spectroscopy; separation processes; monitoring; validation; pollution
. Desenvolvimento e validação da metodologia SPE-LC-MS/MS para a determinação de fármacos e droga de abuso nas águas da represa Guarapiranga - São Paulo/SP, Brasil. Orientador: Maria Aparecida Faustino Pires. 2015. 224 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2015.tde-28042015-095207. Disponível em: http://repositorio.ipen.br/handle/123456789/23697. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validação de metodologia analítica para a determinação de fármacos em amostyras de água, superficial e tratada, utilizando a cromatografia líquida de ultra performance acoplada a espectrometria de massas tandem (UPLC-MS/MS) / Development and validation of analytical methodology for determination of pharmaceutical compounds in surface and surface treated water samples by ultra performance liquid chromatography coupled to tandem mass spectrometry (UPLC-MS/MS) . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 91 p. Orientador: Maria Aparecida Faustino Pires. DOI: 10.11606/D.85.2011.tde-29062012-131108 Abstract: O relevante conceito de sustentabilidade dos dias atuais leva a população a pensar no tratamento dos recursos naturais e principalmente na qualidade e escassez da água. A grave problemática quanto à gestão dos resíduos urbanos no país, desde sua produção, coleta e disposição final são os desafios colocado aos municípios e a sociedade em geral. O uso cada vez mais abundante dos medicamentos farmacêuticos gera uma demanda de resíduos que acabam atingindo os leitos dos rios. Com avanço das tecnologias é possível monitorar e conhecer os resíduos que afetam indiretamente e diretamente as águas das bacias hidrográficas. O objetivo deste trabalho foi desenvolver e validar uma metodologia analítica para a determinação dos resíduos de fármacos (ácido acetil salicílico, diclorofenaco de sódio, paracetamol, ibuprofeno e fenoprofeno) em águas utilizando a cromatografia líquida de ultra performance acoplada à espectrometria de massas tipo tandem (UPLC-MS/MS). Foram utilizadas duas fases moveis distintas. Para os fármacos paracetamol e diclofenaco foi utilizado como fase móvel água: metanol (1:1; V/V) com adição de ácido fórmico e a ionização de eletrospray em modo positivo; para os fármacos acetil salicílico, ibuprofeno e fenoprofeno foi utilizado água: metanol (1:1; v/v) com adição de acetato de amônio e a ionização de eletrospray em modo negativo. O desempenho do método foi avaliado quanto aos seguintes parâmetros: especificidade e seletividade, faixa de trabalho, linearidade; limite de detecção e limite de quantificação, exatidão, robustez e incerteza de medição. Os resultados obtidos comprovaram a adequabilidade do método ao propósito supracitado. Os valores obtidos para o limite de decisão (ccα) e capabilidade de detecção (ccβ) foram: paracetamol 0,21 e 0,34 μg L -1; diclofenaco 2,42 e 3,24 μg L -1 ; AAS 1,56 e 2,45 μg L -1; ibuprofeno 2,34 e 3,21 μg L -1 e fenoprofeno 1,89 e 2,33 μg L-1, respectivamente. A metodologia foi aplicada na caracterização de amostras de água superficial (bruta) e tratada proveniente de áreas de captação e de tratamento de água da bacia hidrográfica do Paraíba do Sul. Foram realizadas duas coletas distintas, setembro/ 2010 e novembro/ 2010, nos municípios de Guararema, São José dos Campos, Taubaté e Pindamonhangaba. Em 31,2 % das amostras, Cinco amostras de água bruta das 16 amostras analisadas, foram encontrados resíduos de paracetamol. Os resultados obtidos apresentaram-se em uma faixa de concentração de 0,10 a 0,50 μg L -1.
Palavras-Chave: water treatment; sample preparation; drugs; residues; chromatography; mass spectroscopy; analytical solution; validation; rivers; brazil
. Desenvolvimento e validação de metodologia analítica para a determinação de fármacos em amostyras de água, superficial e tratada, utilizando a cromatografia líquida de ultra performance acoplada a espectrometria de massas tandem (UPLC-MS/MS). Orientador: Maria Aparecida Faustino Pires. 2012. 91 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2011.tde-29062012-131108. Disponível em: http://repositorio.ipen.br/handle/123456789/9936. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validação de metodologia analítica para determinação de disruptores endócrinos resultantes de atividade antrópicas nas águas da região do Rio Paraíba dos Sul, SP / Development and validation of analytical methodology for determination of endocrine disruptors from anthropic activities in waters at region of Paraíba do Sul, River, SP . 2011. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 186 p. Orientador: Elaine Arantes Jardim Martins. DOI: 10.11606/D.85.2011.tde-25082011-144150 Abstract: Neste estudo foi realizada a avaliação de seis substâncias sintéticas resultantes de processos industriais e de atividades antropogênicas dietilftalato, dibutilftalato, nonilfenol, pentaclorofenol, bisfenol A e benzo[a]pireno os quais possuem capacidade de interferir negativamente no funcionamento normal do sistema endócrino de animais e de seres humanos (xenoestrógenos), em águas tratada e bruta de quatro municípios do Vale do Paraíba paulista. Para tanto, utilizou-se um método analítico de alta seletividade e sensibilidade, sendo a determinação por cromatografia gasosa acoplada ao detector de espectrometria de massas (GC/MS), precedida da concentração das amostras pelo método SPE (extração em fase sólida). Como não são suficientes apenas boas técnicas analíticas para garantir a qualidade dos dados gerados e a confiabilidade dos resultados, a metodologia desenvolvida foi submetida ao processo de validação, onde foram avaliados os parâmetros: seletividade, especificidade, linearidade, faixa linear de trabalho, limites de detecção e quantificação, precisão, exatidão, recuperação e robustez, além da incerteza na medição. Os resultados demonstraram que o método proposto é adequado para quantificação das amostras do rio Paraíba do Sul, e pela sua aplicação foi constatada a presença de todos os poluentes estudados tanto na água bruta quanto na potável em pelo menos um dos três períodos de amostragem, sendo as maiores concentrações mensuradas nas águas brutas e no período seco. Estes resultados evidenciam que as atividades antrópicas na região influenciam a qualidade da água do recurso hídrico estudado, bem como a qualidade da água de distribuição.
Palavras-Chave: brazil; water quality; water treatment; endocrine diseases; synthetic materials; validation; sample preparation; gas chromatography; mass spectroscopy
. Desenvolvimento e validação de metodologia analítica para determinação de disruptores endócrinos resultantes de atividade antrópicas nas águas da região do Rio Paraíba dos Sul, SP. Orientador: Elaine Arantes Jardim Martins. 2011. 186 f. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2011.tde-25082011-144150. Disponível em: http://repositorio.ipen.br/handle/123456789/10015. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Desenvolvimento e validação de um referencial metodológico para avaliação da cultura de segurança de organizações nucleares / Development and validation of a methodological framework for assessing the safety culture of nuclear organizations . 2017. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 128 p. Orientador: Antonio Carlos de Oliveira Barroso. DOI: 10.11606/T.85.2017.tde-25102017-123810 Abstract: A cultura de segurança na área nuclear é definida como o conjunto de características e atitudes da organização e dos indivíduos que fazem que, com uma prioridade insuperável, as questões relacionadas à proteção e segurança nuclear recebam a atenção assegurada pelo seu significado. Até o momento, não existem instrumentos validados que permitam avaliar a cultura de segurança na área nuclear. Em vista disso, os resultados da definição de estratégias para o seu fortalecimento e o acompanhamento do desempenho das ações de melhorias tornam-se difíceis de serem avaliados. Este trabalho teve como objetivo principal desenvolver e validar um instrumento para a avaliação da cultura de segurança de organizações nucleares, utilizando o Instituto de Pesquisas Energéticas e Nucleares como unidade de pesquisa e coleta de dados. Os indicadores e variáveis latentes do instrumento foram definidos utilizando como referência modelos de avaliação de cultura de segurança da área da saúde e área nuclear. O instrumento de coleta de dados proposto inicialmente foi submetido à avaliação por especialistas da área nuclear e, posteriormente, ao pré-teste com indivíduos que pertenciam à população pesquisada. A validação do modelo foi feita por meio da modelagem por equações estruturais utilizando o método de mínimos quadrados parciais (Partial Least Square - Structural Equation Modeling PLS-SEM), no software SmartPLS. A versão final do instrumento foi composta por quarenta indicadores distribuídos em nove variáveis latentes. O modelo de mensuração apresentou validade convergente, validade discriminante e confiabilidade e, o modelo estrutural apresentou significância estatística, demonstrando que o instrumento cumpriu adequadamente todas as etapas de validação.
Palavras-Chave: safety analysis; safety culture; risk assessment; communications; human factors; shielding; working conditions; personnel; emergency plans; mto model; reliability; optimization; radiation protection; licensing regulations; probabilistic estimation; equations; partial differential equations; structure-activity relationships; attitudes; behavior; learning; public anxiety; public opinion; computer codes; statistical mechanics; validation; evaluation; comparative evaluations; nuclear facilities
. Desenvolvimento e validação de um referencial metodológico para avaliação da cultura de segurança de organizações nucleares. Orientador: Antonio Carlos de Oliveira Barroso. 2017. 128 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2017.tde-25102017-123810. Disponível em: http://repositorio.ipen.br/handle/123456789/28035. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Determinação de endotoxina bacteriana (pirogênio) em radiofármacos pelo método de formação de gel. Validação / Determination of bacterial endotoxin (pyrogen) in radiopharmaceuticals by the gel clot method. Validation . 2008. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 77 p. Orientador: Constancia Pagano Goncalves da Silva. DOI: 10.11606/D.85.2008.tde-13102011-144714 Abstract: Antes do Ensaio do Lisado de Amebócitos do Limulus (LAL), a única forma de se avaliar a pirogenicidade em drogas parenterais e dispositivos médicos era o ensaio de pirogênio em coelhos da Farmacopéia Americana (USP). Especialmente para radiofármacos, o ensaio LAL é a escolha para a determinação de endotoxina bacteriana (pirogênio). O objetivo deste trabalho foi validar o método de formação de gel para alguns radiofármacos sem uma interferência mensurável. O guia do método LAL do Food and Drug Administration (FDA) define interferência como uma condição que causa uma diferença significativa entre os pontos finais de gelificação das séries de controle positivo da água e controle positivo do produto utilizando-se um endotoxina padrão. Os experimentos foram realizados de acordo com o teste de endotoxinas bacterianas da USP na m-iodobenzilguanidina-131I, nos radioisótopos Gálio-67 e Tálio-201, nos reagentes liofilizados DTPA, Fitato, GHA, SAH e Sn Coloidal. A Máxima Diluição Válida (MDV) foi calculada para cada produto com base na sua dose clínica e diluições seriadas abaixo da MDV foram avaliadas em duplicata para a detecção de interferências. A sensibilidade declarada do reagente de LAL foi de 0,125 UE mL-1 (Unidades de Endotoxina por mililitro). Para a validação, uma série de diluições foi feita utilizando-se padrão de endotoxina (PE) nas concentrações de 0,5 a 0,03 UE mL-1 para a confirmação da sensibilidade do reagente de LAL, em quadruplicata. A mesma série de diluições foi feita com o PE e o produto diluído 100 vezes em três lotes consecutivos de cada radiofármaco. Os produtos m-iodobenzilguanidina-131I, Gálio-67, Tálio-201, DTPA, SAH e Sn Coloidal foram compatíveis com o método no fator de diluição 1:100. Fitato e GHA apresentaram interferência no ensaio de formação de gel. Outras técnicas para determinar endotoxinas como o ensaio cromogênico (desenvolvimento de cor) e o turbidimétrico (desenvolvimento de turbidez) foram avaliadas para obter informações qualitativas e quantitativas sobre as concentrações de endotoxinas nas amostras.
Palavras-Chave: pyrogens; radiopharmaceuticals; validation
. Determinação de endotoxina bacteriana (pirogênio) em radiofármacos pelo método de formação de gel. Validação. Orientador: Constancia Pagano Goncalves da Silva. 2008. 77 f. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2008.tde-13102011-144714. Disponível em: http://repositorio.ipen.br/handle/123456789/11606. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Determinação multielementar de elementos traços em radiofármacos produzidos na Diretoria de Radiofarmácia por espectrometria de emissão por plasma / Multielemental determination of trace elements in radiopharmaceuticals produced at the Radiopharmacy Center using ICP-OES technique . 2013. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 86 p. Orientador: Margareth Mie Nakamura Matsuda. DOI: 10.11606/D.85.2013.tde-07022014-085443 Abstract: Os radiofármacos são preparações farmacêuticas, que contém radionuclídeo, utilizados em medicina nuclear. O objetivo desse trabalho foi estudar as concentrações de elementos químicos, principalmente metais, em amostras de radiofármacos ALBUMINA-TEC, DEX 70-TEC, DEX 500-TEC, DISIDATEC, DMSA-TEC, EC-TEC, DTPA-TEC, FITATO-TEC, GHA-TEC, MDP-TEC, MIBI-TEC, PIRO-TEC, FDG-Flúor-18, GERADOR IPEN-TEC, IODO-131 SOLUÇÃO. As análises foram realizadas em equipamento Vista MPX simultâneo ICP-OES (Agilent, Australia). A validação do método foi realizado segundo os critérios descritos na RDC n° 899: Guia para validação de métodos analíticos e bioanalíticos de 29 de maio de 2003. De acordo com a Farmacopeia Americana (USP), as impurezas elementares com potencial toxicidade devem ser quantificados. Uma proposta de revisão USP 35 introduz a técnica de espectrometria de emissão atômica para a análise de elementos. Os resultados de validação das análises no ICP-OES indicam a necesidade de controle da limpeza e manutenção do equipamento, alterações do sample uptake delay e avaliação da robustez com as linhas do Mg. As curvas analíticas e faixas de concentracões analisadas foram lineares com r > 0,99. Os resultados de DPR foram abaixo de 5%. Todos os resultados dos parâmetros avaliados estão de acordo com os estabelecidos pela ANVISA.
Palavras-Chave: radiopharmaceuticals; sample preparation; concentration ratio; elements; trace amounts; icp mass spectroscopy; radioisotope generators; brazilian cnen; quality control; validation
. Determinação multielementar de elementos traços em radiofármacos produzidos na Diretoria de Radiofarmácia por espectrometria de emissão por plasma. Orientador: Margareth Mie Nakamura Matsuda. 2013. 86 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2013.tde-07022014-085443. Disponível em: http://repositorio.ipen.br/handle/123456789/10551. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo da produção do radiofármaco FLT-18F em sistema automatizado: contribuição para a validação do processo / Study of the production of the radiopharmaceutical sup(18)F-FLT in automated system: Contribution for process validation . 2013. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 132 p. Orientador: Elaine Bortoleti de Araujo. DOI: 10.11606/D.85.2013.tde-04072013-140325 Abstract: O radiofármaco FLT-18F é um análogo do nucleosídeo timidina e um promissor marcador da proliferação tumoral para imagens em PET. A síntese deste radiofármaco não é simples e, muitas vezes, apresenta baixos rendimentos. Este radiofármaco já vem sendo estudado há alguns anos, porém, não há produção, nem estudos clínicos, no Brasil. O estudo do processo produtivo e a sua adequação às diretrizes de Boas Práticas de Fabricação (ANVISA) são de extrema importância. Este trabalho teve como objetivo estudar a síntese deste radiofármaco, avaliar os métodos de controle de qualidade que serão utilizados na rotina de produção futura, realizar estudos de citotoxicidade, estudos de biodistribuição e imagens PET em animais, contribuindo para o desenvolvimento e elaboração do protocolo de validação de processo e estabelecimento das metodologias analíticas a serem utilizadas durante a rotina de produção. Inicialmente, foi estudada a síntese e produção do produto FLT-18F, com a avaliação de três temperaturas diferentes de marcação, a m de vericar o comportamento do rendimento radioquímico e a estabilidade do produto nal. Os estudos de metodologia analítica compreenderam as análises de identicação radionuclídica, determinação dos pers cromatográcos, pureza radioquímica, solventes residuais e pH. Estudos in vitro do FLT- 18F de internalização e citotoxicidade também foram feitos. Nos estudos in vivo, avaliou-se a farmacocinética, biodistribuição em animais sadios e em animais com modelos tumorais, além de imagens PET/CT de animais com melanoma. O produto nal apresentou alta pureza radioquímica e mostrou-se estável por até 10 horas após a síntese, porém obteve-se um rendimento radioquímico relativamente baixo, conforme descrito na literatura. As metodologias analíticas testadas mostraram-se adequadas para o uso no controle de qualidade do FLT-18F. Nos estudos in vitro o FLT-18F apresentou uma signicativa porcentagem de ligação às células tumorais e a molécula não radiomarcada não foi considerada tóxica para estas células estudadas. A biodistribuição e as imagens apresentaram resultados compatíveis com o esperado. As contribuições para a validação de processo foram satisfatórias e auxiliarão na validação futura do processo produtivo do radiofármaco em estudo.
Palavras-Chave: radiopharmaceuticals; fluorine 18; isotope production; quality control; cytology; toxicity; positron computed tomography; validation; chromatography; radiochemistry
. Estudo da produção do radiofármaco FLT-18F em sistema automatizado: contribuição para a validação do processo. Orientador: Elaine Bortoleti de Araujo. 2013. 132 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2013.tde-04072013-140325. Disponível em: http://repositorio.ipen.br/handle/123456789/10521. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo de esteróis como marcadores químicos em águas destinadas ao abastecimento público na Região do Rio Paraíba do Sul, SP. Desenvolvimento e validação de metodologia analítica / Study sterols as markers chemical in water supply for the public in the Region of the Paraíba do Sul River, SP. Development and validationof analytical methodology . 2012. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 168 p. Orientador: Elaine Arantes Jardim Martins. DOI: 10.11606/D.85.2012.tde-23102012-151457 Abstract: Estudos recentes na região do rio Paraíba do Sul, SP, apontaram a presença de estrógenos e xenoestrógenos e em virtude deste contexto, identificou-se a necessidade de investigar determinados compostos representantes da classe dos esteróis, marcadores químicos mais utilizados em estudos sobre o aporte de esgotos em matrizes ambientais. A metodologia desenvolvida e validada para determinar os esteróis coprostanol, colesterol, colestanol e estigmasterol em amostras de água bruta e tratada utilizou a técnica de SPE para extração e concentração e as técnicas de derivatização e GC/MS para determinação dos compostos. Por meio do processo de validação, a metodologia desenvolvida se mostrou adequada para a identificação e quantificação dos esteróis em virtude de sua exatidão, precisão, robustez, recuperação e incerteza do método. A validação forneceu confiabilidade estatística aos dados, confirmando a sensibilidade e a seletividade do método, além da boa linearidade nas faixas de trabalho consideradas. Aplicando o procedimento analítico validado nas amostras coletadas, constatou-se que o colesterol foi o esterol predominante com concentrações médias de 1,2 μg L-1 para matriz de água bruta e 0,4 μg L-1 para matriz de água tratada. O coprostanol apresentou concentração média de 0,5 μg L-1 para matriz de água bruta enquanto seu isômero colestanol apresentou concentração média de 0,4 μg L-1. O fitoesteróide estigmasterol apresentou concentração média de 0,2 μg L-1 em águas superficiais. O coprostanol foi observado apenas na terceira coleta de água tratada com concentração média de 0,27 μg L-1 e o colestanol com concentração média de 0,37 μg L-1 nesta mesma amostra. Esses resultados proporcionaram uma avaliação preliminar da área de estudo com relação ao aporte de esgoto doméstico contribuindo com o plano de gestão de recursos hídricos da região do Rio Paraíba do Sul, SP indicando o nível de contaminação gerado nas águas de abastecimento público. Este trabalho está vinculado a uma parceria entre o Instituto de Pesquisas Energéticas e Nucleares (IPEN) e a Companhia de Saneamento Básico do Estado de São Paulo (SABESP).
Palavras-Chave: water reservoirs; water supply; chromatography; mass spectroscopy; sterols; tracer techniques; trace amounts; validation; chemical analysis; brazil
. Estudo de esteróis como marcadores químicos em águas destinadas ao abastecimento público na Região do Rio Paraíba do Sul, SP. Desenvolvimento e validação de metodologia analítica. Orientador: Elaine Arantes Jardim Martins. 2012. 168 f. Dissertação (Mestrado) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2012.tde-23102012-151457. Disponível em: http://repositorio.ipen.br/handle/123456789/10113. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo do pior caso na validação de limpeza de equipamentos de produção de radiofármacos de reagentes liofilizados. Validação de metodologia de carbono orgânico total / Worst-case study for cleaning validation of equipments in the radiopharmaceutical production of lyophilized reagents. Metodology validation of total organic carbon . 2015. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 125 p. Orientador: Margareth Mie Nakamura Matsuda. DOI: 10.11606/D.85.2017.tde-07042017-144551 Abstract: Os radiofármacos são definidos como preparações farmacêuticas contendo um radionuclídeo em sua composição, são administrados intravenosamente em sua maioria, e, portanto, o cumprimento dos princípios de Boas Práticas de Fabricação (BPF) é essencial e indispensável à tais produtos. A validação de limpeza é um requisito das BPF e consiste na evidência documentada que demonstra que os procedimentos de limpeza removem os resíduos a níveis pré-determinados de aceitação, garantindo que não haja contaminação cruzada. Uma simplificação da validação dos processos de limpeza é admitida, e consiste na escolha de um produto, denominado de "pior caso" ou worst case, para representar a limpeza de todos os equipamentos da mesma linha de produção. Uma das etapas da validação de limpeza é o estabelecimento e validação do método analítico para quantificação do resíduo. O objetivo deste estudo foi estabelecer o pior caso para a validação de limpeza dos equipamentos de produção de reagentes liofilizados-RL para marcação com 99mTc, avaliar a utilização do teor de carbono orgânico total (COT) como indicador de limpeza dos equipamentos utilizados na fabricação dos RL, validar o método para determinação de CONP (carbono orgânico não purgável/volátil) e realizar testes de recuperação com o produto escolhido como pior caso. A escolha do produto pior caso baseou-se no cálculo de um índice denominado "índice para pior caso - Worst Case Index (WCI)", utilizando informações de solubilidade dos fármacos, dificuldade de limpeza dos equipamentos e taxa de ocupação dos produtos na linha de produção. O produto indicado como pior caso entre os RL foi o MIBI-TEC. Os ensaios de validação do método foram realizados utilizando-se um analisador de carbono modelo TOC-Vwp acoplado a um amostrador automático modelo ASI-V, ambos da marca Shimadzu® e controlados por software TOC Control-V Shimadzu®. Foi utilizado o método direto de quantificação do CONP. Os parâmetros avaliados na validação do método foram: conformidade do sistema, robustez, linearidade, limites de detecção (LD) e de quantificação (LQ), precisão (repetibilidade e precisão intermediária), e exatidão (recuperação) e foram definidos como: 4% acidificante, 2,5 mL de oxidante, tempo de integração da curva de 4,5 minutos, tempo de sparge de 3,0 minutos e linearidade na faixa de 40-1000 μgL-1, com coeficiente de correlação (r) e soma residual dos mínimos quadrados (r2) > 0,99 respectivamente. LD e LQ para CONP foram 14,25 ppb e 47,52 ppb, respectivamente, repetibilidade entre 0,11 4,47%; a precisão intermediária entre 0,59 a 3,80% e exatidão entre 97,05 - 102,90%. A curva analítica para Mibi mostrou-se linear na faixa de 100-800 μgL-1, com r e r2 > 0,99, apresentando parâmetros similares aos das curvas analíticas de CONP. Os resultados obtidos neste estudo demonstraram que a abordagem do pior caso para validação de limpeza é um meio simples e eficaz para diminuir a complexidade e morosidade do processo de validação, além de proporcionar uma redução nos custos envolvidos nestas atividades. Todos os resultados obtidos nos ensaios de validação de método CONP atenderam as exigências e especificações preconizadas pela norma RE 899/2003 da ANVISA para considerar a metodologia validada.
Palavras-Chave: cleaning; equipment; radiopharmaceuticals; production; specifications; freeze protection; carbon sources; organic compounds; reagents; validation; inspection; comparative evaluations
. Estudo do pior caso na validação de limpeza de equipamentos de produção de radiofármacos de reagentes liofilizados. Validação de metodologia de carbono orgânico total. Orientador: Margareth Mie Nakamura Matsuda. 2015. 125 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2017.tde-07042017-144551. Disponível em: http://repositorio.ipen.br/handle/123456789/27504. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo dos parâmetros de estabilidade de travamento entre implante dentário e componente protético através do sistema cone Morse / Study on the stability parameters of locking between dental implants and prosthetic component system through the Morse taper . 2014. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. 89 p. Orientador: Jesualdo Luiz Rossi. DOI: 10.11606/T.85.2014.tde-29092015-083645 Abstract: Na implantodontia visa-se dois grandes resultados para os desdentados parciais e totais, função mastigatória e estética. Ambos têm o mesmo grau de importância, para tanto se deve pensar no que se tem de mais seguro e prático nos dias de hoje. O cone Morse, na implantodontia oral, é um sistema de estabilidade entre o implante dentário e o parafuso intraósseo de sustentação. Para seu correto uso se faz necessário uma série de análise de suas características e condições. No presente trabalho focou-se em desenvolver protocolo de validação de torque, além de analisar parâmetros de acabamento, deformação e estabilidade précarga e pós-carga dentro de protocolos já recomendados. Avaliou-se sua condição antes e após os efeitos de carga mastigatória simulada por ensaio de fadiga. Concluiu-se que o uso do cone Morse dentro dos protocolos indicados deve ser revisto quanto a padrões similares de torque nos pilares sólidos e indexados, cada um possui limites e indicações diferentes para se manter estável. Concluiu-se também que não é um sistema totalmente livre de trânsito de bactérias e que esse trânsito aumenta de forma proporcional ao uso e força mastigatória, indicando que melhorias no acabamento entre as peças devem ser implementadas e/ou adição de material que afaste crescimento bacteriano priorizando a saúde do periodonto e do tecido ósseo de sustentação mantendo o sistema seguro em longevidade.
Palavras-Chave: dentistry; implants; prostheses; bacteria; torque; validation; mechanical properties; biological materials; scanning electron microscopy
. Estudo dos parâmetros de estabilidade de travamento entre implante dentário e componente protético através do sistema cone Morse. Orientador: Jesualdo Luiz Rossi. 2014. 89 f. Tese (Doutorado em Tecnologia Nuclear) - Instituto de Pesquisas Energeticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/T.85.2014.tde-29092015-083645. Disponível em: http://repositorio.ipen.br/handle/123456789/24069. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo e validação da dosimetria em condições de não-referência / Estudy and validation of dosimetry in non-reference conditions . 2011. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 60 p. Orientador: Lara Natal Rodrigues. DOI: 10.11606/D.85.2011.tde-25082011-105058 Abstract: Com o avanço tecnológico dos equipamentos utilizados em radioterapia tornaram-se possíveis o uso de alguns campos de radiação nomeados como campos pequenos em algumas modalidades especiais de radioterapia. Com isso, a dosimetria dos feixes de radiação também teve de ser revista, pois com estes novos tamanhos de campos, não há condição de referência como aquela dita nos protocolos e diretrizes de dosimetria. Neste trabalho foi realizado um estudo completo sobre os campos pequenos, bem como sua dosimetria, mostrando o comportamento dos detectores nessa nova condição de dosimetria através de uma comparação entre os detectores utilizados e dados já publicados na literatura. Além disso, os dados obtidos experimentalmente puderam ser validados através de comparação com dados publicados por outros autores. Na caracterização do detector de diamante o mesmo apresentou-se apropriado em todos os parâmetros para medidas com campos pequenos. Na análise do fator de qualidade Q os resultados experimentais obtidos nesta investigação mostraram diferenças percentuais de 1,8%; 4,0% e 4,9% para câmara do tipo CC01, CC13 e diodo estereotáxico respectivamente. Na avaliação de PDP e TMR foi possível observar a dificuldade nas medições com campos pequenos bem como na comparação de diferentes detectores, para PDP a maior diferença foi de 2,6% e para TMR 2,7%.
Palavras-Chave: dosimetry; radiation detectors; crystal counters; validation
. Estudo e validação da dosimetria em condições de não-referência. Orientador: Lara Natal Rodrigues. 2011. 60 f. Dissertação (Mestrado) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2011.tde-25082011-105058. Disponível em: http://repositorio.ipen.br/handle/123456789/10012. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Estudo para implantação do processo de produção do radiofármaco FES-18F em sistema automatizado : abordagem de validação de processo e de métodos analíticos / Study for implementation of the production process of the radiopharmaceutical FES-18F in an automated system: approach to process validation and analytical methods . 2020. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 121 p. Orientador: Elaine Bortoleti de Araújo. DOI: 10.11606/D.85.2020.tde-18092020-140952 Abstract: O radiofármaco 16α-[18F]-fluoro-17β-estradiol (FES-18F) é uma molécula lipofílica com características in vivo semelhantes ao estradiol e tem alta afinidade de ligação aos receptores de estrogênio (ER), que se encontram super expresso em 75% dos casos de câncer de mama. Esta afinidade faz com que seja um radiofármaco promissor para utilização, por método não-invasivo de tomografia de emissão de pósitrons (PET), para diagnóstico de câncer de mama ER+, avaliando o tamanho do tumor e sítios da doença, auxiliando no prognóstico do tratamento individualizado do paciente, bem como para verificar o câncer de mama recidivo e monitoramento da doença com o tratamento hormonal. O processo de síntese do radiofármaco FES-18F iniciou-se com a obtenção do radionuclídeo flúor-18, na forma ionizada (18F-), em acelerador cíclotron e a síntese automatizada ocorreu em módulo GE TRACERLab MX® por reação de substituição nucleofílica, envolvendo a fluoração [18F] do precursor, hidrólise dos grupos de proteção e pôr fim a purificação em cartuchos compactados. O rendimento radioquímico foi reprodutivo, independente da atividade de flúor-18 na entrada no módulo e está de acordo a literatura encontrada. No caso particular de radiofármacos e, em específico, do FES-18F, não existem metodologias descritas para validação dos processos produtivos e das metodologias analíticas. A ferramenta FMEA foi empregada para análise de risco do processo produtivo e guias da Anvisa e do IMNETRO foram considerados para validação de metodologia analítica. Os estudos de controle de qualidade compreenderam as análises de determinação da Pureza Radionuclídica e Pureza Radioquímica por cromatografia em camada delgada (CCD) e cromatografia a líquido de alta eficiência (CLAE), identidade radionuclídica, detecção do TBA-HCO3 como impureza, determinação de solvente residual (acetonitrila e etanol), pH, determinação de endotoxinas bacterianas (pirogênios) e teste de esterilidade. Com rendimento radioquímico reprodutivo, os lotes de FES-18F produzidos apresentaram alta Pureza Radionuclídica e radioquímica, bem como atenderam a todos os critérios de aceitação dos ensaios realizados para liberação de lotes. O produto mostrou-se estável por até 6 horas após a síntese. As metodologias analíticas testadas mostraram-se adequadas para o uso e a metodologia analítica para análise da porcentagem de Pureza Radioquímica foi validada. Nos estudos in vivo, avaliou-se a biodistribuição em animais sadios e em animais com modelo tumoral desenvolvido com células MCF-7 e os estudos apresentaram resultados compatíveis com a literatura consultada, observando-se captação do FES-18F nos órgãos com receptores de estrogênio, tumor e significativa captação no fígado e intestinos, possivelmente relacionada à excreção preferencial pela via intestinal, com perfil metabólico semelhante ao estradiol. Os resultados deste trabalho serão utilizados para implantação da produção e controle de qualidade rotineiros do radiofármaco FES-18F no Centro de Radiofarmácia do IPEN-CNEN, bem como no processo de registro deste radiofármaco junto à ANVISA.
Palavras-Chave: fabrication; process development units; radiopharmaceuticals; synthesis; fluoroestradiol; fluorine 18; diagnostic techniques; computerized control systems; sample preparation; validation; analytical solution; positron reactions; positron beams; positron sources; positron computed tomography
. Estudo para implantação do processo de produção do radiofármaco FES-18F em sistema automatizado : abordagem de validação de processo e de métodos analíticos. Orientador: Elaine Bortoleti de Araújo. 2020. 121 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2020.tde-18092020-140952. Disponível em: http://repositorio.ipen.br/handle/123456789/31508. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
-
. Fatores associados à mortalidade na Leishmaniose visceral grave em Araguaína - TO: Caracteristicas epidemiológicas, clínicas e laboratoriais (2002 a 2015) / Factors assessed to mortality in severe visceral Leishmany in Araguaina-TO: epidemiological, clinical and laboratory characteristics (2002 to 2015) . 2016. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. 88 p. Orientador: Nanci do Nascimento. DOI: 10.11606/D.85.2017.tde-07042017-093151 Abstract: A Leishmaniose Visceral (LV) é uma doença infecciosa de carater sistêmico. Estima-se que 350 milhões de pessoas no mundo estão expostas ao risco de infecção, com uma prevalência de 12 milhões de infectados e letalidade mundial de 59.000 casos por ano (OMS), sendo que 90%dos casos de LV ocorrem em países onde existe grande parte da população em situação de pobreza.Na América Latina a maioria dos casos ocorre no Brasil (96%) com média de 3.500 casos/ano. As áreas de maior endemia encontram-se nas regiões mais carentes do Norte e Nordeste.A donça afeta animais e o homem, podendo levar ao óbito em 100% dos casos, tendo como seu principal vetor a Lutzomyia longipalpis e como agente etiológico, a Leishmania Infantum. O Estado do Tocantins apresenta elevado número de casos autóctones, e é considerada área endêmica pelo Minisério da Saúde devido a doença estar presente na maioria dos seus municípios. A cidade de Araguaína, com 55,8% dos casos do Tocantins, é classificada pelo Ministério da Saúde como área de transmissão intensa.O objetivo geral deste trabalho foi analisar casos confirmados de Leishmaniose visceral grave CID-B55 internados no Hospital de Doenças Tropicais do Tocantins (HDT), na cidade de Araguaína - TO que evoluíram para óbito no periodo de janeiro de 2002 a dezembro de 2015. Pretendeu-se identificar e descrever dados epidemiológicos, clínicos e laboratoriais, e variáveis relacionadas ao tratamento. Foi feito um estudo epidemiológico, observacional, retrospectivo, descritivo, utilizando dados secundários de prontuários médicos de pacientes internados, no Hospital de Doenças Tropicais do Estado do Tocantins, na cidade de Araguaína - TO. Resultados: sexo masculino, 60,8 e 39,2% sexo feminino. 49,2% idade entre 0 e 10 anos; 20% maiores de 51 anos. Local de procedência em relação ao município 40,9% são de Araguaína; e ao Estado a 89% são do Tocantins. Presença de febre em 70,8%; esplenomegalia e hepatomegalia 76,7%. Hemoglobina < 7g/dl 50%, plaquetopenia 76,7%;leucopenia 50% e hipoalbuminemia 84,9%.Tempo de febre até a internação > que 30 dias 30,8%; Tempo de diagnóstico 5,1 dias; tempo de diagnóstico ao óbito 11,6 dias; RIFI 1/80 em 53,3%; Teste Rápido positivo 88,2% droga de escolha para tratmento foi Glucantime 43% seguida por anfotericina 32% e anfotericina lipossomal 25%. A principal causa do óbito na DO(Declaração de aÓbito) foi kalazar 33,3% e também Infecções respiratorias 31,7%.Conclui-se que a maior incidencia ocorre em individuo do sexo masculino menores de 10 anos, residentes no Estado do Tocantins, apresentando quadro febril prolongado, anemia severa e hipoalbuminemia grave, podendo este quadro ter influenciado na evolução ao óbito.
Palavras-Chave: parasites; diseases; disease vectors; epidemiology; etiology; immunoassay; bioassay; inspection; feasibility studies; testing; validation; evaluated data; comparative evaluations; brazil
. Fatores associados à mortalidade na Leishmaniose visceral grave em Araguaína - TO: Caracteristicas epidemiológicas, clínicas e laboratoriais (2002 a 2015). Orientador: Nanci do Nascimento. 2016. 88 f. Dissertação (Mestrado em Tecnologia Nuclear) - Instituto de Pesquisas Energéticas e Nucleares - IPEN-CNEN/SP, São Paulo. DOI: 10.11606/D.85.2017.tde-07042017-093151. Disponível em: http://repositorio.ipen.br/handle/123456789/27878. Acesso em: $DATA.Como referenciar este itemEsta referência é gerada automaticamente de acordo com as normas do estilo IPEN/SP (ABNT NBR 6023) e recomenda-se uma verificação final e ajustes caso necessário.
Itens para a visualização no momento 1-20 de 30
Buscar no repositório
Navegar
Minha conta
Visualizar
A pesquisa no RD utiliza os recursos de busca da maioria das bases de dados. No entanto algumas dicas podem auxiliar para obter um resultado mais pertinente.
✔ É possível efetuar a busca de um autor ou um termo em todo o RD, por meio do Buscar no Repositório , isto é, o termo solicitado será localizado em qualquer campo do RD. No entanto esse tipo de pesquisa não é recomendada a não ser que se deseje um resultado amplo e generalizado.
✔ A pesquisa apresentará melhor resultado selecionando um dos filtros disponíveis em Navegar
✔ Os filtros disponíveis em Navegar tais como: Coleções, Ano de publicação, Títulos, Assuntos, Autores, Revista, Tipo de publicação são autoexplicativos. O filtro, Autores IPEN apresenta uma relação com os autores vinculados ao IPEN; o ID Autor IPEN diz respeito ao número único de identificação de cada autor constante no RD e sob o qual estão agrupados todos os seus trabalhos independente das variáveis do seu nome; Tipo de acesso diz respeito à acessibilidade do documento, isto é , sujeito as leis de direitos autorais, ID RT apresenta a relação dos relatórios técnicos, restritos para consulta das comunidades indicadas.

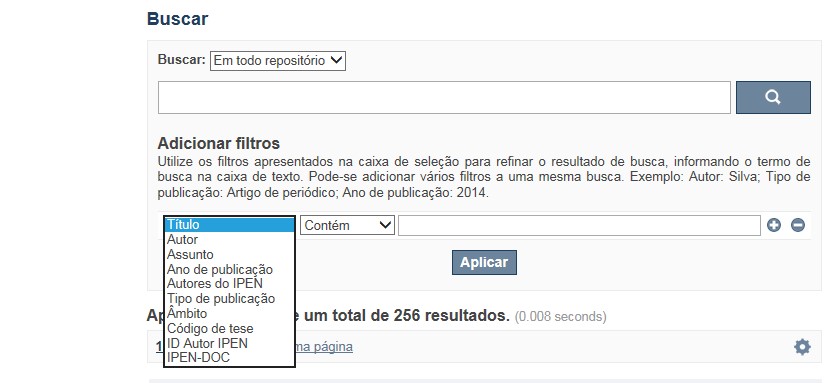
A opção Busca avançada utiliza os conectores da lógica boleana, é o melhor recurso para combinar chaves de busca e obter documentos relevantes à sua pesquisa, utilize os filtros apresentados na caixa de seleção para refinar o resultado de busca. Pode-se adicionar vários filtros a uma mesma busca.
Exemplo:
Buscar os artigos apresentados em um evento internacional de 2015, sobre loss of coolant, do autor Maprelian.
Autor: Maprelian
Título: loss of coolant
Tipo de publicação: Texto completo de evento
Ano de publicação: 2015
✔ Para indexação dos documentos é utilizado o Thesaurus do INIS, especializado na área nuclear e utilizado em todos os países membros da International Atomic Energy Agency – IAEA , por esse motivo, utilize os termos de busca de assunto em inglês; isto não exclui a busca livre por palavras, apenas o resultado pode não ser tão relevante ou pertinente.
✔ 95% do RD apresenta o texto completo do documento com livre acesso, para aqueles que apresentam o ![]() significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
significa que e o documento está sujeito as leis de direitos autorais, solicita-se nesses casos contatar a Biblioteca do IPEN,
bibl@ipen.br
.
✔ Ao efetuar a busca por um autor o RD apresentará uma relação de todos os trabalhos depositados no RD. No lado direito da tela são apresentados os coautores com o número de trabalhos produzidos em conjunto bem como os assuntos abordados e os respectivos anos de publicação agrupados.
✔ O RD disponibiliza um quadro estatístico de produtividade, onde é possível visualizar o número dos trabalhos agrupados por tipo de coleção, a medida que estão sendo depositados no RD.
✔ Na página inicial nas referências são sinalizados todos os autores IPEN, ao clicar nesse símbolo ![]() será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
será aberta uma nova página correspondente à aquele autor – trata-se da página do pesquisador.
✔ Na página do pesquisador, é possível verificar, as variações do nome, a relação de todos os trabalhos com texto completo bem como um quadro resumo numérico; há links para o Currículo Lattes e o Google Acadêmico ( quando esse for informado).
ATENÇÃO!
ESTE TEXTO "AJUDA" ESTÁ SUJEITO A ATUALIZAÇÕES CONSTANTES, A MEDIDA QUE NOVAS FUNCIONALIDADES E RECURSOS DE BUSCA FOREM SENDO DESENVOLVIDOS PELAS EQUIPES DA BIBLIOTECA E DA INFORMÁTICA.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
1. Portaria IPEN-CNEN/SP nº 387, que estabeleceu os princípios que nortearam a criação do RDI, clique aqui.
2. A experiência do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN/SP) na criação de um Repositório Digital Institucional – RDI, clique aqui.
O Repositório Digital do IPEN é um equipamento institucional de acesso aberto, criado com o objetivo de reunir, preservar, disponibilizar e conferir maior visibilidade à Produção Científica publicada pelo Instituto, desde sua criação em 1956.
Operando, inicialmente como uma base de dados referencial o Repositório foi disponibilizado na atual plataforma, em junho de 2015. No Repositório está disponível o acesso ao conteúdo digital de artigos de periódicos, eventos, nacionais e internacionais, livros, capítulos, dissertações, teses e relatórios técnicos.
A elaboração do projeto do RI do IPEN foi iniciado em novembro de 2013, colocado em operação interna em julho de 2014 e disponibilizado na Internet em junho de 2015. Utiliza o software livre Dspace, desenvolvido pelo Massachusetts Institute of Technology (MIT). Para descrição dos metadados adota o padrão Dublin Core. É compatível com o Protocolo de Arquivos Abertos (OAI) permitindo interoperabilidade com repositórios de âmbito nacional e internacional.
O gerenciamento do Repositório está a cargo da Biblioteca do IPEN. Constam neste RI, até o presente momento 20.950 itens que tanto podem ser artigos de periódicos ou de eventos nacionais e internacionais, dissertações e teses, livros, capítulo de livros e relatórios técnicos. Para participar do RI-IPEN é necessário que pelo menos um dos autores tenha vínculo acadêmico ou funcional com o Instituto. Nesta primeira etapa de funcionamento do RI, a coleta das publicações é realizada periodicamente pela equipe da Biblioteca do IPEN, extraindo os dados das bases internacionais tais como a Web of Science, Scopus, INIS, SciElo além de verificar o Currículo Lattes. O RI-IPEN apresenta também um aspecto inovador no seu funcionamento. Por meio de metadados específicos ele está vinculado ao sistema de gerenciamento das atividades do Plano Diretor anual do IPEN (SIGEPI). Com o objetivo de fornecer dados numéricos para a elaboração dos indicadores da Produção Cientifica Institucional, disponibiliza uma tabela estatística registrando em tempo real a inserção de novos itens. Foi criado um metadado que contém um número único para cada integrante da comunidade científica do IPEN. Esse metadado se transformou em um filtro que ao ser acionado apresenta todos os trabalhos de um determinado autor independente das variáveis na forma de citação do seu nome.
